Robert Bolye hat Experimente mit einem u-förmigen Glasrohr durchgeführt. Dieses war an einem Ende zugeschmolzen
und am anderen offen. Er füllte es so mit Quecksilber (Hg), daß in dem verschlossenem Rohr ein kleines
Volumen an
Luft übrig blieb:
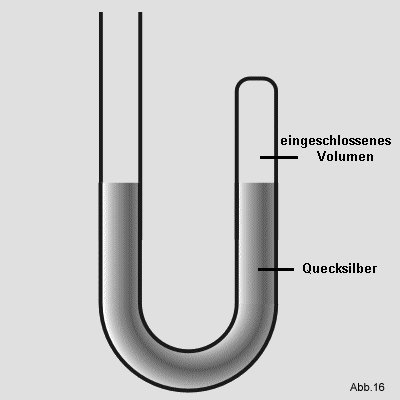
In das offene Ende füllte er weiteres Quecksilber nach. Die eingeschlossene Luft wurde dadurch einem höheren
Druck ausgesetzt und das Volumen verringerte sich. Durch Messungen des Drucks und der Volumenverringerung,
stellte Boyle fest, daß sich das Volumen halbierte, wenn der Druck verdoppelt wurde.
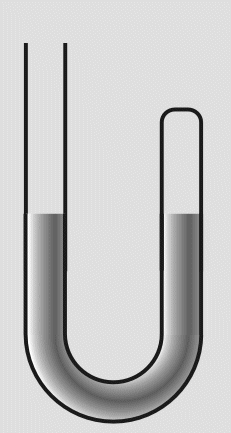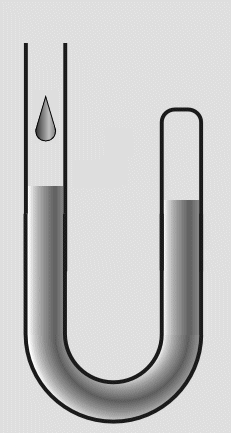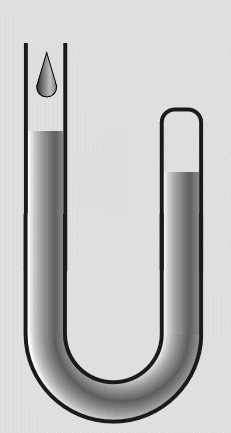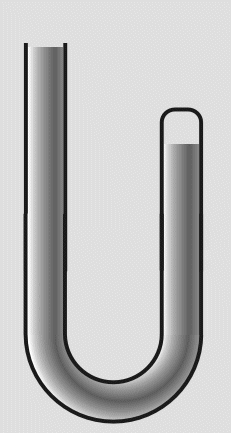 Abb.17
Abb.17
Dieser Zusammenhang ist
proportional, d.h. egal um welchen Wert der
Druck verändert wird, das Volumen verändert sich immer im gleichen Verhältnis. Daraus
ergibt sich, daß Druck und Volumen indirekt proportional sind, denn das Volumen wird kleiner bei größerem Druck
bzw. größer bei kleinerem Druck. Das läßt sich durch folgende Gleichung darstellen:
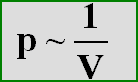 | (8) |
anders geschrieben:
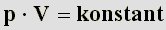 | (9) |
Dabei ist zu beachten, daß die
Temperatur bei Boyles Versuchen immer gleich war.
Trägt man die Volumen- und Druckwerte in ein Koordinatensystem ein, bekommt man folgenden Graph:
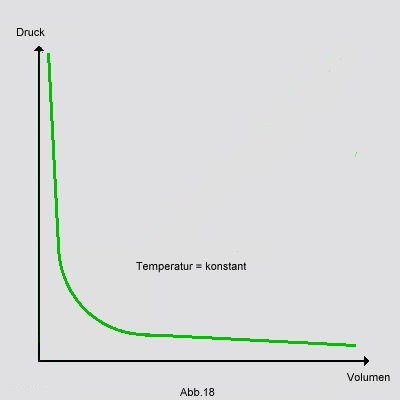
Hat man mehrere zusammengehörige Volumen/Druckwertpaare, so kann man deren Produkte immer gleich setzen, da das
Ergebnis immer konstant ist:
 | (10) |
Der Franzose
Edmé Mariotte fand den gleichen Zusammenhang ein paar Jahre später heraus,
daher der Name,
Boyle-Mariott´sches Gasgesetz.
Beispiel:
Man hat einen Luftballon, der mit einem
idealen Gas gefüllt ist :
 Gegeben:
Gegeben: Sein Volumen ist 1,3 dm
3. Der Luftdruck außerhalb des Ballons
beträgt 1013
mbar (millibar).
Die Gummihülle des Ballons ist dehnbar, würde jedoch bei einem Volumen von 1,78 dm
3
platzen.
Frage: Bis zu welchem Luftdruck kann man ihn aufsteigen lassen, bis er platzt?
Lösung: Da sich die Temperatur nicht ändert, kann man das ideale Gasgesetz von Boyle-Mariotte anwenden.
Es lautet wie folgt:
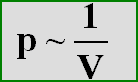
Dies kann man auch umschreiben, indem man die beiden Variablen auf eine Seite bringt:
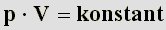
Da alle Druck/Volumenwertpaare immer den gleichen konstanten Wert ergeben, kann man sie gleichsetzen. In diesem
Fall liegen nur zwei Druck/Volumenwertpaare vor, die nun gleichgesetzt werden:

In diese Gleichung werden nun die gegebenen Werte einsetzt und es wird nach p
2
aufgelöst:
 Antwort:
Antwort: Der Luftballon platzt bei einem Luftdruck von 739,8 mbar.