[griechisch: en tropos = im Wechsel]
Die
Enthalpie kann nicht die einzige Ursache sein, die eine spontane Reaktion auslöst. Es gibt
auch Reaktionen, die von alleine ablaufen, und endotherm sind. Manche Salze z.B., lösen sich in Wasser unter Abkühlung auf.
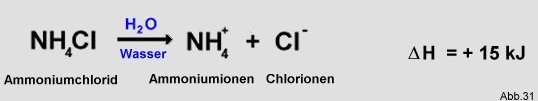
Diese Reaktionen sind folglich endotherm. Ein Beispiel hierfür ist Ammoniumchlorid, das sich in Wasser in Ammoniumionen
und Chlorionen auflöst :
Außerdem gibt es Reaktionen, die
nicht freiwillig ablaufen, obwohl sie
exotherm sind.
Das Gefrieren von Wasser z.B. ist ein exothermer Vorgang und sie läuft trotzdem nicht spontan ab.
Welche Antriebskraft ist für diese Tatsachen zuständig?
Im Jahre 1850 führte
R. Clausius eine neue Größe ein, die in der
Thermodynamik den Zustand eines
Systems beschreibt.
Er nannte sie
Entropie S. Sie ist ein Maß für die „Unordnung“. Herrscht große Unordnung, so ist auch ihr Zahlenwert groß. Umso
geordneter ein System jedoch ist, desto kleiner ist der Zahlenwert der Entropie.
Um das anschaulich erklären zu können, wird ein Gefäß betrachtet, das mit Wasser gefüllt ist. In dieses Gefäß gibt man
einen Salzkristall:

Der Salzkristall hat einen sehr hohen Ordnungsgrad. Die einzelnen Ionen liegen in einem streng geordneten Schema vor.
Bringt man diesen Kristall nun mit Wasser in Kontakt, so lösen sich zuerst die äußeren Ionen ab und verteilen sich im
Wasser:

Nun liegen die Ionen sehr viel ungeordneter vor als im Kristall.
Die Reaktion an sich ist endotherm, da die Gitterbildungsenergie wieder überwunden werden muss, um das Kristallgitter
aufzulösen. Diese benötigte Energie zieht sich der Kristall aus dem Wasser, das sich deswegen abkühlt. Der Grad an
Unordnung jedoch steigt an, was den Vorgang spontan ablaufen läßt.
Der Antrieb zum Erstreben einer größeren Unordnung kommt von der Wahrscheinlichkeit. Unordnung ist einfach viel
wahrscheinlicher als Ordnung. Betrachtet man ein Kartenspiel, so gibt es nur eine Möglichkeit der Ordnung, in dem die
Karten der Zahlenreihenfolge nach geordnet sind, jedoch weitaus mehr Möglichkeiten, die Karten in einer
nichtgeordneten Reihenfolge zu kombinieren:
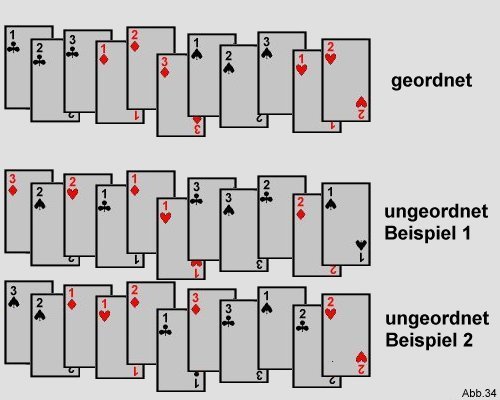
Die Liste der ungeordneten Beispiele ließe sich sehr weit fortsetzen.
Der Wert der Entropie in einem
isolierten System ist auch als
Maß für die innere
Stabilität zu verstehen.
Je größer der Zahlenwert ist, desto stabiler ist das System und desto kleiner ist die Möglichkeit für spontane
Veränderungen.
Genauso wie die
Enthalpie ist die Entropie eine
Zustandsgleichung. Jede Änderung des Zustands führt auch zu einer
Entropieänderung:

Die Entropie kann man nicht an einem an einem Punkt messen, sondern immer nur die Differenz zu einem anderen Zustand.
Sie wird in J/kmol gemessen.
In einer spontan ablaufenden Reaktion steigt die Entropie immer an, kein Stoff wird sich von selbst in einen geordneten
Zustand begeben. Ein
Gas z.B. verteilt sich immer gleichmäßig in einem Behälter und konzentriert sich nicht nur in einem
Eck, was mehr geordnet wäre. Die Entropie in einem System kann nur dann sinken, wenn zugleich an einem anderen Ort die
Entropie wertmäßig mehr ansteigt. Daraus folgt, daß die
Gesamtentropie immer steigen muss. Nach
Clausius strebt das Universum aufgrund dieser Tatsache
dem sog. "
Wärmetod" entgegen. Darunter versteht er den endgültigen
Gleichgewichtszustand,
an dem die Entropie ihren
höchsten Wert erreicht hat und keine Systeme mehr zu spontanen Reaktionen fähig sind. Arthur Eddington nannte
die Entropie den "Pfeil der Zeit". Wird die Entropie des Universums an zwei unterschiedlichen Zeitpunkten bestimmt,
so ist der Zeitpunkt mit dem größeren Wert immer später, als der mit dem Kleineren. Somit wird die Richtung der Zeit
durch die Entropievermehrung im Universum bestimmt.
Zitate von Wissenschaftlern:
L.Boltzmann erkannte:
"Die auf die einzelnen Moleküle eines Körpers verteilte
Bewegungsenergie geht stets von einem weniger wahrscheinlichen Verteilungszustand in einen wahrscheinlicheren
über, nicht aber umgekehrt. Sind z. B. alle Luftmoleküle zu Anfang in einer Ecke eines Zimmers, so verteilen sie
sich gleichmäßig in diesem Zimmer: die Entropie nimmt zu. Es ist jedoch praktisch ausgeschlossen, dass umgekehrt
die gleichmäßig verteilten Moleküle sich einmal alle in einer Zimmerecke ansammeln."