AG Golenhofen: Stresstoleranz im Nervensystem
Endogene Schutzmechanismen ermöglichen es vielen Zelltypen Schädigungen durch Sauerstoffmangel oder Noxen vorübergehend zu kompensieren. Eine wichtige Rolle spielt dabei die Gruppe der Stressproteine, deren Synthese in Zellen bei Stressereignissen induziert wird. Die Induktion dieser Proteine führt dazu, dass ein kurzfristiges Stressereignis zu einer nachfolgenden transienten Toleranz gegenüber einem normalerweise letalen Stress führt. Den Stressproteinen wird somit eine protektive Rolle bei verschiedenen pathophysiologischen Vorgängen zugesprochen.
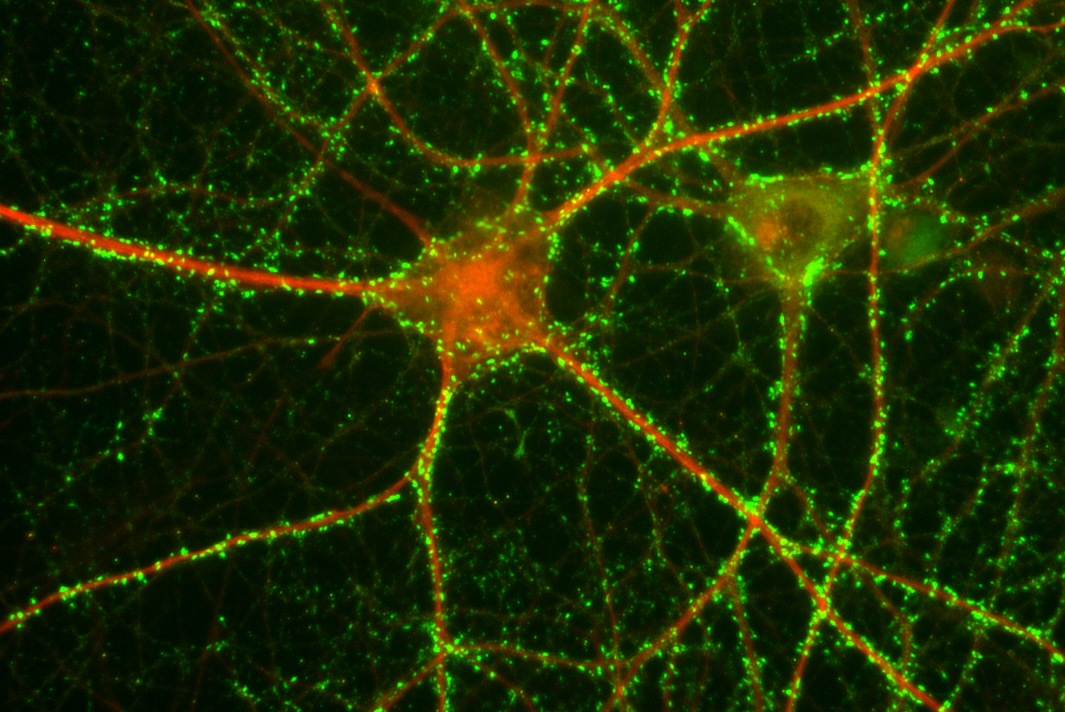
Die Arbeitsgruppe untersucht die Funktion, Regulation und molekularen Wirkmechanismen der Familie der so genannten kleinen Hitzeschockproteine (z.B. Hsp27/HspB1, alpha-B-Crystallin/HspB5) in Nervenzellen. Es ist bekannt, dass diese Proteine neuroprotektive Effekte ausüben und auch bei vielen neurodegenerativen Erkrankungen, wie z.B. bei Morbus Alzheimer, eine große Rolle spielen. So werden sie bei diesen Erkrankungen verstärkt synthetisiert, assoziieren mit den krankheitsursächlichen Proteinaggregaten und scheinen dieser Aggregation entgegen zu wirken. In diesem Projekt verwenden wir vielfältige Methoden der Molekularbiologie, Biochemie, Zellkultur und der Mikroskopie. Wir konnten eine neue Funktion von HspB5 in Neuronen beschreiben, und zwar die Regulation der Komplexität des Dendritenbaumes. Die genauen Wirkmechanismen, sowie die Bedeutung dieses Effektes bei neurodegenerativen Erkrankungen werden derzeit in der Arbeitsgruppe weiter untersucht.
Projektleiter:
Prof. Dr. Nikola Golenhofen
Mitarbeiter:
PD Dr. Britta Bartelt-Kirbach
Bianca Mekle
Stephanie Sues
cand. med.Hartmut Raisch
cand. med. Jan-Luca Dreßler
cand. med. Jaquline Berg
