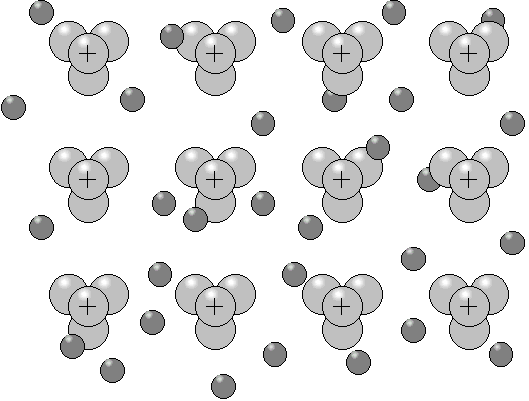
Positiver Metallrumpf mit delokalisiertem Elektronengas.
Schon um 1900 wurde ein Modell der metallischen Bindung von Drude und Lorentz vorgeschlagen. Im Gegensatz zum ionischen Kristallgitter, in dem die Gitterplätze abwechselnd mit positiven und negativen Teilchen belegt sind, besteht das Metallgitter aus nur positiven Atomrümpfen, die Valenzelektronen sind innerhalb des Gitters statistisch verteilt. Durch die freie Beweglichkeit sind die Elektronen nicht mehr fest an einen Atomrumpf gebunden, sondern delokalisiert. Da sich die Elektronen ähnlich wie ein Gas verhalten, spricht man auch von einem Elektronengas. Nimmt man das Beispiel Aluminium, das drei Valenzelektronen besitzt, kann man sich leicht vorstellen, dass das Elektronengas den größten Teil des Volumens ausmacht. So nehmen die Aluminium3+-Rümpfe nur 18% des Gesamtvolumens ein, 82% entfallen dagegen auf das delokalisierte Elektronengas.
 |
|
|
Abbildung 3:
Positiver Metallrumpf mit delokalisiertem Elektronengas. |
Die elektrische Leitfähigkeit von Metallen wird heute über die Bändertheorie erklärt.
Die Bindung im Kristall wird hierbei mit Hilfe von Molekülorbitalen beschrieben, die
sich über den ganzen Kristall ausdehnen. Exemplarisch soll dies anhand des Lithiums
besprochen werden:
Im Li2-Kristall überlappen sich die 2s-Orbitale der beiden Atome
und bilden zwei Molekülorbitale. Ein bindendes s-Orbital und ein antibindendes
s*-Orbital. Im Grundzustand ist nur das energieärmere, bindende s-Orbital mit 2 Elektronen
besetzt, das energiereichere, antibindende s*-Orbital bleibt leer.
Die 2s-Orbitale von zwei getrennten Li-Atomen sind entartet, d.h. sie besitzen beide
die gleiche Energie. Beim Zusammenfügen der beiden Atome spalten sich die Energieniveaus
auf, es bildet sich ein Orbital höherer und ein Orbital niedrigerer Energie. Bringt
man nun ein drittes Li-Atom ins Spiel, bilden sich drei Energieniveaus, ein antibindendes
mit höherer Energie, ein nichtbindendes mit unveränderter Energie und ein drittes
bindendes mit niedrigerer Energie. Bei vier Atomen im Li-Kristall bilden sich vier
Energieniveaus. Je mehr Atome zusammengefügt werden, desto mehr getrennte aber enger
beieinander liegende Energieniveaus bilden sich.
Die Molekülorbitale besitzen alle eine andere Energie, sie sind also nicht entartet.
Die Gesamtheit dieser Molekülorbitale nennt man ein Band. Die Orbitale im unteren Teil
des Bandes wirken bindend, die im oberen Teil antibindend.
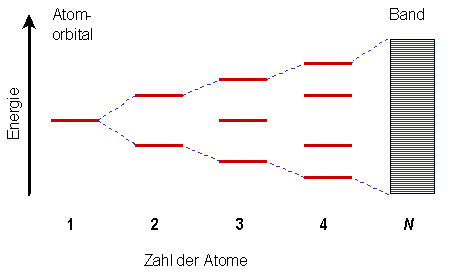 |
|
|
Abbildung 4:
Entstehung eines Bandes durch die Wechselwirkungen der 2s-Orbitale. |
Da es sich beim 2s-Elektron des Lithiums um ein Valenzelektron handelt, nennt man das entstandene Band auch Valenzband. Im Falle des Lithiums ist immer nur die untere Hälfte mit Elektronen besetzt, die durch Wärmeenergie aber leicht in ein höheres antibindendes Molekülorbital gehoben werden können. Die Wanderung der Elektronen in höhere oder aber auch zurück in tiefere Energieniveaus ermöglichen, dass Lithium Strom leitet.
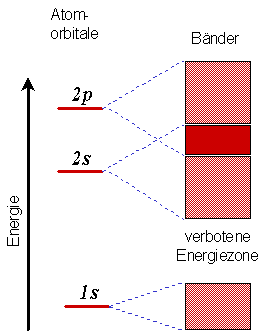 |
|
|
Abbildung 5:
Überschneidung des 2s- und des 2p-Bandes im metallischen Lithium. |
Betrachtet man nun Beryllium, ein Element der zweiten Hauptgruppe, so stellt man fest,
dass die beiden 2s-Elektronen eines Atoms zusammen mit zwei weiteren 2s-Elektronen eines
anderen Be-Atoms nicht nur das energetisch günstigere s-Orbital besetzen, sondern auch
das antibindende s*-Orbital. Die Molekülorbitale des
entstandenen Valenzbandes sind also alle voll besetzt. Die Elektronen können innerhalb
dieses Bandes nicht den Platz wechseln, und Beryllium wäre somit nicht in der Lage Strom
zu leiten.
Nun bewegen sich die Elektronen eines Atoms in verschiedenen Orbitalen mit
unterschiedlicher Energie um den Atomkern. Das nächst höhere Orbital, nach dem 2s-Orbital,
ist das 2p-Orbital. Auch hier bilden sich in einem Kristall Molekülorbitale aus.
Das entstandene Band überschneidet sich energetisch mit dem
2s-Band. Die Elektronen des Berylliums können durch Energiezufuhr in ein freies
p-Molekülorbital überwechseln und Strom leiten. Das 2p-Band wird auch als Leitungsband
bezeichnet.
In Abbildung 5 ist zudem noch das Band des 1s-Orbitals dargestellt. Dieses Band ist mit
Elektronen voll besetzt, es überschneidet sich mit keinem weiteren Band und ist vom
2s-Band durch eine verboten Zone ("Energy Gap") getrennt. Kein Elektron kann
eine Energie in diesem verbotenen Bereich annehmen.
Die hohe Beweglichkeit von Elektronen, also auch die Stromleitfähigkeit, ist immer dann
gegeben, wenn ein Band nicht voll besetzt ist, oder wenn sich ein volles Band mit einem
leeren Band überschneidet. Die Elektronenübergänge erfordern nur sehr wenig
Anregungsenergie, die durch Zufuhr von thermischer Energie verfügbar ist. Fällt ein Elektron
in ein tieferes Energieniveau zurück, wird Licht freigesetzt. Diese Elektronenübergänge
tragen zum metallischen Glanz von Metallen bei.
Durch die unterschiedlichen Besetzungen und Überschneidungen von Bändern kann man drei verschiedene Typen von Festkörpern unterscheiden:
Leiter
Das Valenzband ist nur teilweise besetzt oder/und es überschneidet sich bei allen
Metallen mit einem Leitungsband. Alkalimetalle besitzen teilweise besetzte
Valenzbänder. Bei Erdalkalimetalle dagegen ist das Valenzband fast aufgefüllt.
Wird eine Spannung angelegt, können die Valenzelektronen unbesetzte
Energiezustände besetzten. Wegen des
Pauli-Verbots
müssen die Elektronen auch bei
einer Temperatur von T = 0 K Quantenzustände
höherer Energie besetzen und haben somit bei
T = 0 K einen Energieinhalt. Die oberste
Grenze bis zu der bei T = 0 K die
Energieniveaus besetzt sind heißt Fermi-Energie
EF. Beim Lithium beträgt
die Fermi-Energie 4,7 eV.
Eigenhalbleiter
Das Valenzband in einem Halbleiter ist voll besetzt. Die verbotene Zone ist jedoch
schmal genug, um von thermisch angeregten Elektronen überwunden zu werden. Es entstehen
Lücken im Valenzband, in welche andere Elektronen des Valenzbandes hüpfen können. Die
elektrische Leitung findet im Valenz- und im Leitungsband statt.
Silicium und Germanium sind zum Beispiel solche Halbleiter. Sie kristallisieren im Diamanttyp
(sp3-Hybride),
alle Valenzelektronen werden für die Bindungen im Kristall benötigt; sie stellen ein
vollbesetztes Valenzband dar. Mit zunehmender Temperatur nimmt die elektrische
Leitfähigkeit rapide zu. Elektronen werden aus ihren Bindungen gerissen und können in
das energetisch höher gelegene Leitungsband gelangen.
Isolatoren
Auch hier ist das Valenzband voll besetzt, doch die verbotene Zone ist zu groß, um von
angeregten Elektronen übersprungen zu werden. Selbst bei sehr hoher Energiezufuhr gelangen
nur wenige Elektronen in das Leitungsband. Dies erklärt, warum Isolatoren bei sehr
hohen Temperaturen kaum Strom leiten.
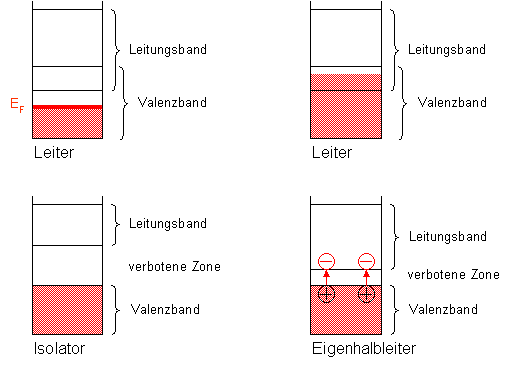 |
|
|
Abbildung 6:
Schematische Bänderdiagramme für Leiter, Isolatoren und Eigenhalbleiter. |