l
Abstand zwischen den Elektroden
Wird mittels zweier Elektroden eine Spannung U an eine Elektrolyt-Lösung angelegt, baut sich zwischen den beiden Elektroden ein elektrisches Feld E auf:
|
|
U l |
angelegte Spannung
Abstand zwischen den Elektroden |
Die negativ geladene Elektrode, die Kathode, zieht die positiven Ionen an, die dann als Kationen bezeichnet werden. Umgekehrt verhält es sich mit den negativen Ionen, die zur positiv geladenen Elektrode, der Anode, wandern und deshalb Anionen genannt werden.
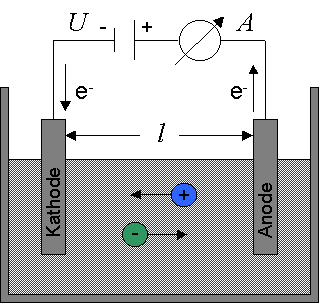 |
|
|
Abbildung 10:
Schema einer elektrochemischen Zelle. |
Auf die Ionen der Sorte i mit der Ladungszahl zi wirkt dann eine Kraft:
|
|
e | Elementarladung eine Elektrons |
Diese Kraft bewirkt, dass die Kationen zur Kathode und die Anionen zur Anode beschleunigt werden. Dieser Beschleunigung wirkt jedoch eine Reibungskraft FR entgegen, da sich die Ionen nicht im Vakuum, sondern in einem flüssigen Medium befinden. Mit Hilfe des Stokes'schen Gesetzes lässt sich die Reibungskraft FR bestimmen:
|
|
ri
vi |
|
Nach einer kurzen Beschleunigung stellt sich eine konstante Geschwindigkeit vi ein:
|
|
Die Geschwindigkeit vi
ist also neben der
Viskosität
![]() des Lösungsmittels
und den charakteristischen Größen
zi und
ri des Ions von der, aus
der angelegten Spannung resultierenden, Feldstärke abhängig. Dividiert man die
Geschwindigkeit vi durch die
Feldstärke E, erhält man die
elektrische Beweglichkeit
ui der Ionen:
des Lösungsmittels
und den charakteristischen Größen
zi und
ri des Ions von der, aus
der angelegten Spannung resultierenden, Feldstärke abhängig. Dividiert man die
Geschwindigkeit vi durch die
Feldstärke E, erhält man die
elektrische Beweglichkeit
ui der Ionen:
|
|
Die Ionenbeweglichkeit sinkt mit wachsender Konzentration, da die interionischen Wechselwirkungen zunehmen. Sie ist zudem noch vom Lösungsmittel, vom Druck und der Temperatur abhängig.