Die Hittorf'sche Überführungszahl
Leitfähigkeitsmessungen liefern immer nur Summen von molaren Leitfähigkeiten
oder Summen von elektrischen Beweglichkeiten von Ionen. Interessant für die Diskussion des
Ionenleitverhaltens wären aber charakteristische Werte für die einzelnen molaren
Leitfähigkeiten der Kationen, beziehungsweise der Anionen.
Wie auch in Kapitel
 Elektrolyte
erwähnt, ist die elektrische Beweglichkeit der
Ionen über ihre Wanderungsgeschwindigkeit im elektrischen Feld definiert. Durch
die Messung der Wanderungsgeschwindigkeit kann man also auf die elektrische
Beweglichkeit schließen. Eine Möglichkeit ist die direkte Beobachtung der
Wanderung bei gefärbten Ionen (z.B. MnO4- ist violett):
Elektrolyte
erwähnt, ist die elektrische Beweglichkeit der
Ionen über ihre Wanderungsgeschwindigkeit im elektrischen Feld definiert. Durch
die Messung der Wanderungsgeschwindigkeit kann man also auf die elektrische
Beweglichkeit schließen. Eine Möglichkeit ist die direkte Beobachtung der
Wanderung bei gefärbten Ionen (z.B. MnO4- ist violett):
|
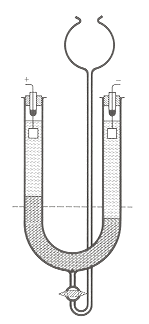 |

Praktisches Vorgehen
Eine Kaliumnitratlösung (hellgrau) unterschichtet man mit einer
MnO4--Lösung (dunkelgrau).Diese wird
zur Dichteerhöhung mit etwas Harnstoff versetzt. Nach dem Ausbilden
einer scharfen Schichtgrenze wird Gleichspannung an das Elektrolysegefäß angelegt.
Die negativ geladenen MnO4--Ionen wandern
zur positiven Kathode. Man kann auf der Kathodenseite des U-Rohres ein Ansteigen
der Schichtgrenze erkennen, auf der Anodenseite ein Absinken. Die Verschiebung der
Schichtgrenze in Abhängigkeit von der Zeit liefert erste Informationen über die
Wanderungsgeschwindigkeit. Zusammen mit der angelegten Spannung und dem
Elektrodenabstand, lässt sich dann die elektrische Beweglichkeit zum Beispiel des
MnO4--Ions bestimmen.
|
|
Abbildung 17:
Elektrolysegefäß zu direkten Messung der
Wanderungsgeschwindigkeit. |
Die direkte Beobachtung der Wanderungsgeschwindigkeit ist aber nur bei gefärbten
Ionen möglich, um aber auch von farblosen Kationen bzw. Anionen die elektrische
Beweglichkeit ermitteln zu können, wird die Bestimmung der Überführungszahlen nach
Hittorf benutzt.
Die Überführungszahl
t+ beschreibt den
Anteil des von Kationen transportierten Stroms. Analog gibt
t- den Anteil
des von Anionen transportierten Stroms an, wobei 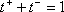 ist:
ist:
Der Gesamtstrom I setzt sich zusammen nach:
Über die Beweglichkeit, die Leitfähigkeit und die Ladung lassen sich folgende
Beziehungen ableiten:
 Elektrolyte
erwähnt, ist die elektrische Beweglichkeit der
Ionen über ihre Wanderungsgeschwindigkeit im elektrischen Feld definiert. Durch
die Messung der Wanderungsgeschwindigkeit kann man also auf die elektrische
Beweglichkeit schließen. Eine Möglichkeit ist die direkte Beobachtung der
Wanderung bei gefärbten Ionen (z.B. MnO4- ist violett):
Elektrolyte
erwähnt, ist die elektrische Beweglichkeit der
Ionen über ihre Wanderungsgeschwindigkeit im elektrischen Feld definiert. Durch
die Messung der Wanderungsgeschwindigkeit kann man also auf die elektrische
Beweglichkeit schließen. Eine Möglichkeit ist die direkte Beobachtung der
Wanderung bei gefärbten Ionen (z.B. MnO4- ist violett):
