Der photoelektrische Effekt, kurz Photoeffekt, wurde von Heinrich Hertz im Jahr 1887 entdeckt und von Philipp Lenard im Jahr 1900 näher untersucht. Dieses Phänomen können wir in einem Versuch beobachten:
Versuch 1: Eine frisch (warum?) geschmirgelte Zinkplatte wird auf einem Elektroskop befestigt und positiv aufgeladen. Danach beleuchten wir sie hintereinander mit einer Rotlicht- und einer Quecksilberlampe. Derselbe Versuch wird mit der negativ aufgeladenen Zinkplatte wiederholt. In den Lichtweg können wir dann eine Glasplatte bringen.
| In der folgenden interaktiven Animation kannst du dieses Experiment selbst durchführen! |
Was beobachten wir in diesem Versuch?
Das Elektroskop wurde nur bei negativer Ladung entladen, und zwar durch eine Quecksilberdampflampe, die sichtbares und ultraviolettes Licht abgibt. Die Entladung des Elektroskops zeigt, dass die überschüssigen Elektronen die Zinkplatte verlassen. Eine Glasplatte im Strahlengang verhindert die Entladung. Wir wissen, dass Glas ultraviolettes Licht absorbiert. Das sagt uns: nur UV-Licht löst Elektronen aus dem Zink.
Bei einer positiv geladenen Zinkplatte passiert das nicht. Das UV-Licht löst zwar Elektronen aus der Platte, die Anziehung der positiven Ladung holt sie aber zurück.
Im Versuch sehen wir außerdem nach der Entladung der negativen Platte im UV-Licht keine weitere Entladung. Die neutrale Platte wird also nicht positiv aufgeladen. Auch hier werden Elektronen herausgelöst, dadurch erhält die Platte einen Elektronenmangel und zieht sie sofort zurück.
Bei Bestrahlung mit rotem Licht wurde die negativ geladene Zinkplatte nicht entladen. Das rote Licht hat eine niedrigere Frequenz als das Ultraviolette. Untersuchungen an anderen Materialien zeigten, dass nur Licht bestimmter Frequenzen Elektronen freisetzt.
Der Photoeffekt ist die Auslösung von Elektronen durch Licht bestimmter Frequenzen aus der Oberfläche von Körpern.
In einem weiteren Experiment wollen wir den Einfluss der Intensität und der Frequenz der Strahlung auf den Photoeffekt untersuchen. Die Intensität I einer elektromagnetischen Strahlung ist als Quotient aus der Energie E, die in einem Zeitintervall ![]() t auf eine Fläche A fällt, und dem Produkt aus dieser Fläche A und dieser Zeit
t auf eine Fläche A fällt, und dem Produkt aus dieser Fläche A und dieser Zeit ![]() t definiert:
t definiert:
| (3.1) |
Die Fläche A soll dabei senkrecht zur Ausbreitungsrichtung der Strahlung stehen.
Versuch 2: In einem evakuierten Gefäß sind zwei metallische Elektroden angebracht: eine Cäsium-Kathode K (analog zur Zinkplatte im Elektroskop) und eine Anode A. Durch ein Fenster aus Quarzglas (auch für UV-Licht durchlässig) wird die Kathode mit Licht verschiedener Frequenzen bestrahlt. Die Intensität des Lichts variieren wir mit Verschieben der Lichtquelle. Je kleiner der Abstand von der Lichtquelle zur Kathode, desto größer die Lichtintensität auf der Kathode! (Warum? Tipp: Licht geht kegelförmig von der Lampe aus.) Während der Beleuchtung können Elektronen aus dem Cäsium austreten. (Der Anschaulichkeit halber werden Elektronen hier wie im Folgenden als kleine Kugeln mit Minus-Zeichen dargestellt.) Wenn einige von ihnen die Anode erreichen, fließt ein Strom, dessen Stärke wir messen.
| Hier unten kannst du interaktiv experimentieren! |
Wie erklären wir dieses Experiment?
Im Gegensatz zu Zink werden aus Cäsium schon von dem niederfrequenten
sichtbaren Licht Elektronen herausgelöst. Die Ursache dafür liegt
an der kleinerer Austrittsarbeit für Elektronen in Alkali-Metallen und
Cäsium ist eines davon. (Die Hintergründe dazu ergeben sich aus dem
Periodensystem der Elemente.) Die Mindestfrequenz für
die Auslösung von Elektronen aus Cäsium liegt bei der von gelbem Licht.
Außerdem beobachten wir, dass die Stromstärke mit zunehmender Intensität
wächst. Das können wir mit dem Wellenmodell des Lichtes verstehen:
Wird die Lichtintensität erhöht, so bedeutet das nach der Definition
der Intensität, Gleichung (3.1): es gibt mehr
Energie für die Elektronenauslösung pro Zeit- und Flächeneinheit.
Rotes Licht ruft auch bei hoher Intensität (kleinem Abstand zum Quarz-Fenster)
keinen Photostrom hervor. Das widerspricht aber der elektromagnetischen Wellenvorstellung
des Lichts: Danach sollten Elektronen durch die periodisch wechselnde elektrische
Feldstärke der Lichtwellen in Schwingungen versetzt werden, so dass ihre
Amplitude so lange zunimmt, bis sie genügend Energie zum Verlassen des
Metalls haben. (Die Energie ist proportional zum Quadrat der Amplitude.) Deswegen
müsste etwas Zeit vergehen, bis die ersten Elektronen freigesetzt werden.
Diese Zeit müsste dann bei stärkerer Beleuchtung kürzer sein.
Jedoch haben wir in diesem Versuch, wie bereits schon im Versuch 1, gemerkt,
dass der Photoeffekt sofort mit der Beleuchtung einsetzt. Bei
großer Intensität (![]() Energie) sollte auch das Licht niedriger Frequenzen (das rote Licht im Experiment)
Elektronen herauslösen!
Energie) sollte auch das Licht niedriger Frequenzen (das rote Licht im Experiment)
Elektronen herauslösen!
Wir fassen unsere Beobachtungen zusammen:
Jeder Stoff braucht für den Elektronenaustritt seine eigene Mindestfrequenz der elektromagnetischen Strahlung: die sog. Grenzfrequenz, die nicht von der Lichtintensität, sondern nur von seiner chemischer Natur abhängt.
Um die kinetische Energie der herausgelösten Elektronen zu bestimmen, wollen wir die Spannung zwischen Anode und Kathode messen:
Versuch 3: Der Aufbau ist analog zum Versuch 2. Hier schließen wir zwischen Kathode und Anode ein Spannungsmessgerät mit großem Innenwiderstand an. Die Kathode wird wieder mit Licht verschiedener Frequenzen bestrahlt.
| Auch hier kannst du den Versuch selbst in Gang bringen! |
Welche Abhängigkeiten können wir hier feststellen?
Einige der freigesetzten Elektronen gelangen auf die Anode. Der Elektronenüberschuss auf der Anode und ihr Mangel auf der Kathode erzeugt ein elektrisches Feld dazwischen. Die Elektronen kommen so lange auf die Anode hinzu, bis das wachsende Feld die weiteren Elektronen abbremst. Sie können somit die Anode nur erreichen, wenn ihre kinetische Energie größer oder gleich der potentiellen Energie des elektrischen Feldes ist:
| (3.2) |
Nachdem das letzte Elektron von der Anode aufgenommen wird, sehen wir, dass die Spannung U ihren maximalen Wert annimmt. Das letzte Elektron ist auch eines der schnellsten: eines mit der maximalen kinetischen Energie. Seine kinetische Energie muss an der Anode vollständig in die maximale potentielle Energie umgewandelt sein:
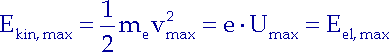 |
(3.3) |
Unser Versuch zeigt darüber hinaus, dass die Spannung nicht vom Abstand zur Lichtquelle abhängt, was bedeutet:
Die maximale kinetische Energie der ausgelösten Elektronen hängt nicht von der Lichtintensität ab.
Aus der Sicht der Wellentheorie des Lichtes ist diese Tatsache nicht zu erklären. Denn je größer die Lichtintensität ist, desto mehr Energie sollte nach der Gleichung (3.1) Elektronen übertragen werden.
Die maximale kinetische Energie der ausgelösten Elektronen wächst mit der Frequenz des eingestrahlten Lichts.
Unsere Messung ergibt folgende Werte für Cäsium als Kathodenmaterial:
| Farbe | gelb | grün | blau | violett |
| Frequenz |
5,19 | 5,50 | 6,88 | 7,41 |
| Spannung Umax in V | 0,15 | 0,30 | 0,90 | 1,10 |
| Energie Ekin, max = Eel, max in eV | 0,15 | 0,30 | 0,90 | 1,10 |
(1 eV ist die Energie, die ein Elektron erhält, wenn es die Spannung 1 V durchläuft.)
Wir tragen Ekin, max gegen die Lichtfrequenz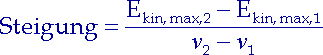 |
(3.4) |
Der Wert dieser Konstanten ist das Plancksche Wirkungsquantum ![]() = 4,136
= 4,136 ![]() 10-15 eV
10-15 eV ![]() s !
s !
Der Abschnitt der verlängerten Geraden auf der Energieachse ist die Austrittsarbeit WA = ![]() G, sie ist die Energieportion, die für den Austritt eines Elektrons notwendig ist. Der Wert der Austrittarbeit ist nur vom Material abhängig.
G, sie ist die Energieportion, die für den Austritt eines Elektrons notwendig ist. Der Wert der Austrittarbeit ist nur vom Material abhängig.
Mit diesen Überlegungen hat Albert Einstein 1905 folgende Geradengleichung für den Photoeffekt aufgestellt:
Einstein-Gleichung |
(3.5) |
Nach Einstein tritt die Lichtenergie nicht in beliebigen Energiebeträgen auf, sondern als Summe kleinster Portionen. Diese Portionen nannte er Photonen. ![]() ist die Energie eines Photons. Für
ist die Energie eines Photons. Für ![]() < WA reicht die Frequenz des Lichtes nicht aus, um Elektronen aus dem Metall herauszulösen. Mit
< WA reicht die Frequenz des Lichtes nicht aus, um Elektronen aus dem Metall herauszulösen. Mit ![]() = 5
= 5 ![]() 1014 Hz tritt der Photoeffekt bei Cäsium ein, jedoch nicht bei Zink.
1014 Hz tritt der Photoeffekt bei Cäsium ein, jedoch nicht bei Zink.
Nicht alle Elektronen haben maximale Geschwindigkeit (maximale
kinetische Energie) beim Verlassen des Metalls. Denn die Arbeit zum Ablösen
eines Elektrons WAbl
kann größer sein als die Austrittsarbeit WA
(z. B. durch Energieverlust an Rotationen). In so einem Fall erhält ein
Elektron eine entsprechend geringere kinetische Energie als die schnellsten
Elektronen, nämlich: Ekin = ![]() - WAbl .
Es gilt:
- WAbl .
Es gilt:
| (3.6) |
Bei höherer Lichtintensität werden nicht etwa Photonen höherer Energie ausgesandt, sondern mehr Photonen gleichzeitig, die auch mehr Elektronen freisetzen können.
Schon beim Deuten der Strahlung eines schwarzen Körpers lag die Vermutung nahe, dass jede elektromagnetische Strahlung teilchenähnliche Eigenschaften besitzt. Wenn ein elektromagnetischer Oszillator der Frequenz ![]() Energie nur als Vielfache von
Energie nur als Vielfache von ![]() aufnehmen oder abgeben kann, so können wir uns vorstellen, dass diese Strahlung aus Teilchen besteht und jedes dieser Teilchen eine Energie
aufnehmen oder abgeben kann, so können wir uns vorstellen, dass diese Strahlung aus Teilchen besteht und jedes dieser Teilchen eine Energie ![]() trägt. Ein Photon ist somit nichts anderes als ein Quant der elektromagnetischen Strahlung! Ursprünglich wurden ausschließlich Quanten der sichtbaren Strahlung als Photonen bezeichnet. Deswegen werden Photonen auch Lichtquanten genannt.
trägt. Ein Photon ist somit nichts anderes als ein Quant der elektromagnetischen Strahlung! Ursprünglich wurden ausschließlich Quanten der sichtbaren Strahlung als Photonen bezeichnet. Deswegen werden Photonen auch Lichtquanten genannt.
Beim Photoeffekt wird zum Ablösen und Beschleunigen eines Elektrons die Energie ![]() = WAbl + Ekin eines Lichtquantes verwendet.
= WAbl + Ekin eines Lichtquantes verwendet.
Der Photoeffekt ist ein weiterer Hinweis auf den Teilchencharakter elektromagnetischer Strahlung.