Lassen wir weißes Licht der Sonne oder einer Glühbirne durch ein Prisma gehen, dann wird es in ein breites, ununterbrochenes Farbband zerlegt. Die Farben erscheinen in der Reihenfolge ihrer Wellenlängen bzw. Frequenzen. Festkörper und Flüssigkeiten, manche Gase unter sehr hohem Druck (z. B. in den Sternen) können durch große Wärmezufuhr zum Leuchten gebracht werden. Solches Licht liefert ein kontinuierliches Emissionsspektrum. Nach dem Wellenmodell des Lichts ist es der sichtbare Bereich aus dem Spektrum elektromagnetischer Wellen.
Wie sehen die Emissionsspektren der Stoffe im gasförmigen atomaren Zustand unter normalem Druck aus?
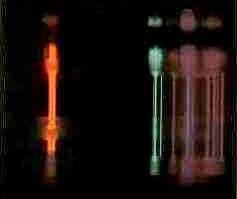
Als erstes verdampfen wir nacheinander Salzlösungen verschiedener Alkalimetalle in der Flamme eines Bunsenbrenners. Dabei beobachten wir die Flamme im Dunkeln mit einem Spektralapparat. Eine Kochsalzlösung (NaCl) färbt die Flamme intensiv orangen, im Spektralapparat sehen wir eine gelbe Linie der Wellenlänge von ca. 590 nm. Salze von Lithium und Kalium senden rötliches Licht aus. Das Spektrum von Lithium sind zwei rote Linien. Das Kalium hat rote und eine violette Linien im Spektrum, wobei die roten nicht mit dem Spektrum von Lithium übereinstimmen.
Um ein Gas, z. B. Wasserstoff zum Leuchten zu bringen, ionisieren wir es in einer Glasröhre durch Anlegen einer Spannung. Ein Beugungsgitter spaltet das Bild unserer Spektralröhre in eine Serie von farbigen parallelen Bildern: das sichtbare Emissionsspektrum von Wasserstoff:
 |
 |
Durch Energiezufuhr können Atome zum Leuchten angeregt werden. Dabei senden sie nur Licht charakteristischer Wellenlängen aus. Ihr diskretes Emissionsspektrum heißt daher Linienspektrum. Es ist für jedes chemische Element einzigartig. Mit der Spektralanalyse können somit chemische Elemente identifiziert werden.
|
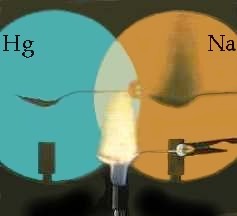
Betrachten wir nun den umgekehrten Vorgang: die Absorption von Licht. Dafür nehmen wir eine Natrium- und eine Quecksilber-Dampflampe und projizieren deren Licht an eine Wand. Zwischen die Wand und die Lampen stellen wir einen Bunsenbrenner. Seine Flamme ist für beide Lichtquellen durchscheinend. Nun bringen wir eine Natriumsalzlösung in die Flamme. Die Na-Lampe wirft jetzt einen Schatten der Flamme an die Wand, während das Bild der Hg-Lampe unverändert bleibt. Die Na-Flamme hat also das Licht der Na-Lampe absorbiert, nicht aber das Licht der Hg-Lampe, obwohl Quecksilber in seinem Emissionsspektrum auch eine gelbe Linie (578 nm) nah zur Linie vom Na-Spektrum (590 nm) hat.
Atome absorbieren Licht derselben Wellenlängen, das sie im leuchtenden Zustand selbst emittieren.
Dieses Ergebnis können wir mit der Quantentheorie erklären.
Atome können nur ganz bestimmte Energiebeträge aufnehmen oder abgeben:
Quanten der charakteristischen Energie E = ![]() .
Kann ein Atom mit einer Energie
.
Kann ein Atom mit einer Energie ![]() zum Leuchten angeregt werden, dann wird genau derselbe Energiebetrag als Lichtquant
ausgestrahlt. Da keine Linie im Hg-Spektrum mit dem Na-Spektrum übereinstimmt,
ist das Licht einer Hg-Lampe aus anderen Frequenzen (
zum Leuchten angeregt werden, dann wird genau derselbe Energiebetrag als Lichtquant
ausgestrahlt. Da keine Linie im Hg-Spektrum mit dem Na-Spektrum übereinstimmt,
ist das Licht einer Hg-Lampe aus anderen Frequenzen (![]() anderen Energiequanten) zusammengesetzt, als das Licht einer Na-Lampe. Deswegen
kann das Hg-Licht Na-Atome nicht zum Leuchten bringen. Diese quantenmechanische
Deutung der Linienspektren führt uns zum Energieniveaumodell des
Atoms:
anderen Energiequanten) zusammengesetzt, als das Licht einer Na-Lampe. Deswegen
kann das Hg-Licht Na-Atome nicht zum Leuchten bringen. Diese quantenmechanische
Deutung der Linienspektren führt uns zum Energieniveaumodell des
Atoms:
Ein Atom kann nur Zustände mit ganz
bestimmten Energien annehmen. Diese Energiezustände
werden auch Energieniveaus genannt. Zur Überführung
des Atoms von einem Energieniveau E 1 in einen anderen Energieniveau E 2
muss das Atom nach dem Energieerhaltungssatz genau das Energiequant
![]() E
= E 2 - E 1 =
E
= E 2 - E 1 = ![]() aufnehmen oder abgeben.
aufnehmen oder abgeben.
1911 bewies Ernest Rutherford in Streuexperimenten die
Existenz eines Atomkerns mit Ladung ![]() , wobei die Kernladungszahl Z
die Anzahl der positiven Elementarladungen e,
also Protonen, im Kern angibt. Sie ist gleich der Ordnungszahl des Elementes
im Periodensystem. Nach Rutherford ist der Atomkern von
einer negativ geladenen Hülle aus Elektronen umgeben.
, wobei die Kernladungszahl Z
die Anzahl der positiven Elementarladungen e,
also Protonen, im Kern angibt. Sie ist gleich der Ordnungszahl des Elementes
im Periodensystem. Nach Rutherford ist der Atomkern von
einer negativ geladenen Hülle aus Elektronen umgeben.
Niels Bohr entwickelte dieses Atommodell weiter. Er nahm an,
dass die Übergänge von einem Energieniveau in ein anderes von Elektronen
vollführt werden. In seinen 1913 veröffentlichten Postulaten
betrachtete Bohr die Elektronen noch als klassische Teilchen:
| me | (10.1) |

|
|
| (10.2) |
für die Bahngeschwindigkeit vn aus der Quantenbedigung einfügen:
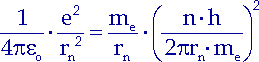
| (10.4) |
und erhalten die Bohrschen Radien:
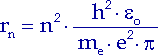
| (10.5) |
Für den Grundzustand ergibt sich der Radius r1 :
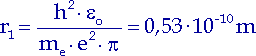
| (10.6) |
Dieser Wert stimmt gut mit anderen gefundenen Werten aus der kinetischen Gastheorie überein. Für jede weitere Elektronenbahn gilt nach Bohr:
| (10.7) |
Die Gesamtenergie des Elektrons En setzt sich zusammen aus seiner kinetischen und seiner elektrostatischen potentiellen Energie. Die potentielle Energie ist negativ, denn Energie muss aufgebracht werden, um das Elektron gegen die Coulombkraft vom Atomkern zu entfernen. Nach dem Auflösen der Gleichung (10.3) nach der Geschwindigkeit vn setzen wir das Ergebnis für vn in den Term der kinetischen Energie ein. Wir stellen fest, dass die kinetische Energie die Hälfte des Betrages der potentiellen Energie darstellt:
| (10.8) |
Diese Gleichung formen wir mit (10.7) und (10.6) um und erhalten folgende Beziehung:
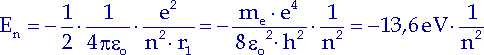
| (10.9) |
Ein Elektron kann in einem Wasserstoffatom nur die folgenden Energiewerte annehmen:
| (10.10) |
wobei die ganze Zahl n seine momentane Bahn bezeichnet.
Aus der Mechanik wissen wir: Im stabilsten Zustand hat ein Körper die niedrigste potentielle Energie. Da die Gesamtenergie eines Elektrons in einem Atom gleich der Hälfte der potentiellen Energie ist, muss der stabilste Zustand eines Atoms der Zustand seiner niedrigsten Gesamtenergie sein. Er wird Grundzustand genannt. Das Wasserstoffatom befindet sich im Grundzustand, wenn die Quantenzahl n = 1 beträgt. Zustände mit größeren Quantenzahlen sind weniger stabil, sie werden angeregte Zustände genannt.
Nun können wir ausrechnen, wieviel Energie beim Übergang eines Elektrons von jedem bestimmten Energieniveau auf ein anderes bestimmte Energieniveau des Wasserstoffatoms verbraucht oder abgegeben wird. Dieser Energiebetrag hängt nur von den zugehörigen Quantenzahlen ab:
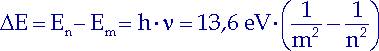
| (10.11) |
Wenn ein Elektron völlig vom Atom getrennt wird, entspricht
es einem Sprung auf eine unendlich große Bahn (m =
![]() ). Das Atom wird zu einem Ion. Die aufzuwendende Ionisierungsenergie z.B. aus dem Grundzustand (n = 1)
beträgt 13,6 eV.
Umgekehrt wird die Energie 13,6 eV frei, wenn
ein Proton ein freies, ruhendes Elektron einfängt und ein Wasserstoffatom bildet.
). Das Atom wird zu einem Ion. Die aufzuwendende Ionisierungsenergie z.B. aus dem Grundzustand (n = 1)
beträgt 13,6 eV.
Umgekehrt wird die Energie 13,6 eV frei, wenn
ein Proton ein freies, ruhendes Elektron einfängt und ein Wasserstoffatom bildet.
Atome können nicht Photonen beliebiger Frequenz absorbieren oder emittieren, sondern nur die, deren Energie dem Unterschied zwischen den erlaubten Energieniveaus entspricht:
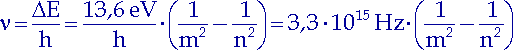
| (10.12) |
Mit dieser Formel lassen sich die Spektren von Wasserstoff und wasserstoffähnlichen Ionen (Ionen mit nur einem Elektron in der Hülle) sehr genau berechnen. Das Diagramm rechts zeigt uns Elektronenübergänge von höheren Energieniveaus auf tiefere Energieniveaus eines Wasserstoffatoms. Ausgestrahlte Photonen derselben Frequenz erscheinen im Spektrum als eine für sie charakteristische Linie. Das Emissionsspektrum von Wasserstoff hat außer den sichtbaren Linien, Balmer-Serie (m = 2, n = 3, 4, 5, ...), auch noch Linien im ultravioletten Bereich, Lyman-Serie (m = 1, n = 2, 3, 4, ...), und im infraroten Bereich, Paschen-Serie (m = 3, n = 4, 5, 6, ...).
Das Bohrsche Modell versagt jedoch bei Atomen mit mehr als einem
Elektron. Schon beim Helium stimmen die berechneten Frequenzen nicht mit den Spektrallinien überein.
Nach Bohr bewegt sich ein Elektron auf einer Kreisbahn, also in einer Ebene,
um den Atomkern. Kinetische Gastheorie und Experimente zeigten jedoch, dass
Wasserstoffatome keine dünnen Scheiben darstellen, sondern kugelförmig sind.
Die Bohrsche Quantenbedingung widerspricht der später (1926) aufgestellten
Heisenbergschen Unschärferelation:
![]() p
p ![]()
![]() x
x
![]() h (mit
h (mit ![]() p
= me
p
= me
![]()
![]() v).
Wenn der Ort des Elektrons (also seine Bahn und damit der Radius) exakt bestimmt
ist, d. h. die Ortsunsicherheit
v).
Wenn der Ort des Elektrons (also seine Bahn und damit der Radius) exakt bestimmt
ist, d. h. die Ortsunsicherheit ![]() x
unendlich klein ist, wird die Unschärfe seiner Geschwindigkeit
x
unendlich klein ist, wird die Unschärfe seiner Geschwindigkeit
![]() v
v
![]() h/(me
h/(me
![]()
![]() x)
unendlich groß sein. Nach Bohr ist jedoch mit dem Radius auch die Bahngeschwindigkeit
exakt berechenbar und umgekehrt.
x)
unendlich groß sein. Nach Bohr ist jedoch mit dem Radius auch die Bahngeschwindigkeit
exakt berechenbar und umgekehrt.
Die Lösung des Problems brachte die Wellenmechanik
von Erwin Schrödinger, in der er mit Hilfe der de-Broglie-Hypothese
das Elektron als Welle behandelte.