Voraussetzungen
Sie haben ein Photometer, mit dem Sie bei den Wellenlängen 420 nm und 640 nm messen können. Außerdem haben Sie Pipetten und Pipettenspitzen, mit denen Sie Volumina genau pipettieren können.
Zeitbedarf: Sie benötigen etwa 30 min zum Ansetzen der Lösungen. Sie können Ihre Messungen jederzeit unter- bzw. abbrechen. Die Messzeit einer einzelnen Probe ist sehr kurz (< 1 Minute). Die Gesamtzeit hängt also von der Anzahl Ihrer Proben ab.
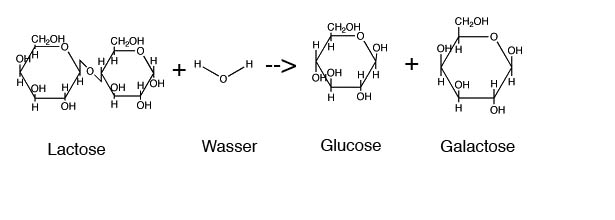
Folgeexperimente: Sie können die Induktion der beta-Galaktosidase in einer E. coli-Kultur messen, eine SDS-PAGE und eventuell einen Western Blot durchführen. Außerdem können Sie durch eine Glucose-Bestimmung die Spaltung des Milchzuckers (Lactose) in Glucose und Galaktose nachweisen.

Aufgabe
- Messen Sie die Aktivität der beta-Galaktosidase mit verschiedenen Substraten (o-NPG, Glucose, X-Gal) unter Standardbedingungen.
- Messen Sie im Vergleich dazu die Aktivität bei verschiedenen pH-Werten, Temperaturen und in Gegenwart verschiedener Hemmstoffe.
- Notieren Sie Ihre Messergebnisse in einer Tabelle und stellen Sie diese Werte graphisch dar.
Lernziele
Sie lernen an einem kommerziellen Präparat die Enzymaktivität der beta-Galaktosidase zu messen. Dabei erproben Sie die optimalen Testbedingungen und die Substratspezifität des Enzyms. Sie werden damit vorbereitet, die Induktion dieses Enzyms in einer wachsenden E. coli Kultur zu messen und das "blau-weiß Screening" zu verstehen.
Zusatzinformationen
Reaktionen | Berechnung der Enzymaktivität | Daten zum Enzym
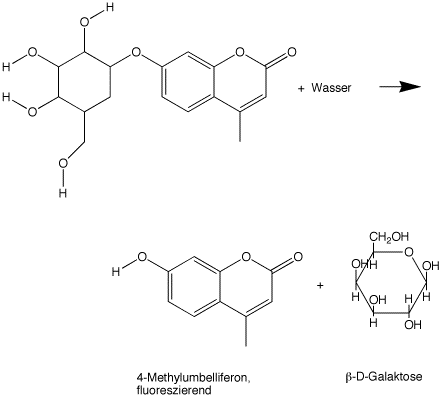
Auch die künstlichen Substrate "X-Gal" (5-Brom-4-Chlor-3-Indoxyl-beta-D-Galactopyranosid), o-NPG und Methylumbelliferyl-Galaktosid verlaufen nach den folgenden Schemata:
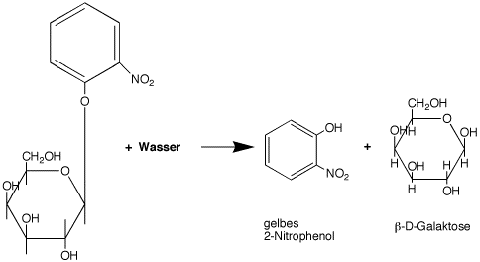
Im Fall der Lactose werden die farblosen Zucker Glucose und Galaktose freigesetzt. Im Fall des X-Gal wird 5-Brom-4-Chlorindol gebildet, das nach Oxidation einen blauen Indigo-Komplex liefert. Aus o-NPGs wird das gelbe 2-Nitrophenol und aus 4-Methylumbelliferyl-Galaktosid das fluoreszierende 4-Methylumbelliferon freigesetzt.
In einer sehr ähnlichen Reaktion wie der letzten wird von E. coli 4-Methylumbelliferyl-beta-D-Glucopyranosid umgesetzt. Die "MUG"-Reaktion ist für den E. coli Nachweis in Wasserproben von großer Bedeutung, weil 4-Methylumbelliferon durch UV-Licht der Wellenlänge 366 nm zu einer grünlichen Fluoreszenz angeregt wird. Damit steht ein sehr empfindlicher und vergleichsweise schneller Nachweis für E. coli zur Verfügung.
Sie überprüfen diese Behauptungen, indem Sie wie im Ansatz "1" des Pipettierschemas (im Abschnitt "Methoden"), anstelle des o-NPGs 150 µl 10 mM X-Gal einsetzen. Wie die blaue Farbe dieser Reaktion zeigt, müssen Sie zur optimalen Messung des Ansatzes die Wellenlänge Ihres Photometers auf 640 nm verstellen.
Pdf-Dateien zu diesen Reaktionen können Sie für Lactose, o-NPG, X-Gal und Methylumbelliferyl-Galaktosid herunterladen.
Berechnung der Enzymaktivität aus einem kommerziellen Enzymprodukt:
Sie finden z.B. folgende Angaben: "1 ml/1500 U". Diese Angaben bedeuten, dass 1,5 U pro µl Suspension (1500 U/1000 µl) vorliegen. Finden Sie die Angabe: "380 U/mg solid", dann müssten Sie 1 mg Pulver in 1000 µl Puffer lösen. Damit wären 0,38 U/µl Puffer (380 U/1000 µl) enthalten.
Daten zum Enzym
Die Daten für die beta-Galaktosidasen aus Escherichia coli und aus Thermus aquaticus wurden der Brenda-Datenbank entnommen.
| Parameter | Escherichia coli | Thermus aquaticus |
| induzierbar | ja | ja |
| Km o-NPG | 0,15 mM | 6,6 mM |
| Km Lactose | 5,5 mM | >36 mM |
| pH-Optimum | pH 6,8 (bei o-NPG und 2 mM Mg2+), | pH 5,5 |
| Temperaturoptimum | 35°C | 80°C (bei pH 7) 70°C (bei pH 5.5) |
Probleme
| Beobachtung | Lösungsansatz |
| Keine Farbreaktion erkennbar. | Haben Sie aktives Enzym pipettiert? Stimmt der pH-Wert des Testansatzes? |
| In allen Ansätzen entwickelt sich eine gelbe Farbe. | Ist durch Zufall o-NPG in alle Anästze Pipettiert worden? Haben Sie für die einzelnen Lösungen frische Pipettenspitzen verwendet? |
| Im X-Gal Ansatz ist auch nach langer Inkubation nur eine schwache Blaufärbung sichtbar. | Schütteln Sie die Probe auf einem Vortexer, um Sauerstoff nachzuliefern. Die Bildung des blauen Komplexes benötigt oxidierende Bedingungen. |
Tipps und Hinweise
- Auch wenn Sie ungenau pipettieren, sollten die Ergebnisse dieses Experimentes eindeutig ausfallen.
- Sammeln Sie alle Testansätze und entsorgen Sie diese Abfälle als flüssigen organischen Abfall.
- Messen Sie Ansätzen mit 1 ml Volumen in reduzierten Küvetten. Damit stellen Sie sicher, dass die Messlösung tatsächlich im Strahlengang steht.
- In diesem Test können Sie preiswerte Plastikküvetten nutzen, da Sie ohne Lösungsmittel im langwelligen Spektralbereich messen.
- Wenn Sie Reagenzgläser verwenden, sehen Sie leichter die Farbentwicklung, als in Eppendorfreaktionsgefäßen.
- Variieren Sie diesen Testansatz zur Messung der pH-Wert Abhängigkeit, der Temperatur, etc.
- Geben Sie eine größere Enzymaktivität zum Ansatz, verläuft die Reaktion schneller.
- Geben Sie zusätzlich eine größere Menge X-Gal zum Testansatz und schütteln Sie diesen Ansatz, so verfärbt er sich schneller blau.
Fragen
- Werden alle Substrate der beta-Galaktosidase mit gleicher Geschwindigkeit umgesetzt?
- Was sind Disaccharide?
- Was verstehen Sie unter einer "EC-Nummer"?
- Wie könnten Sie den molaren Extinktionskoeffizienten von 2-Nitrophenol bestimmen?
- Was ist der "Km-Wert"? Welche Information für einen Enzymtest kann aus dieser Angabe abgeleitet werden?
- Wie erklären Sie die langsamere Farbentwicklung im X-Gal Ansatz?