Entwicklung des dorsalen Rückenmarks
Das Rückenmark stellt eine der wichtigsten Stationen für die Verarbeitung und Weiterleitung sensorischer Informationen, wie z.B. Schmerz, Berührung, oder Körperwahrnehmung (Propriozeption) dar. Morphologische Grundlage dieser Aufgaben sind funktionell unterschiedliche Neuronenpopulationen, die im dorsalen Teil des Rückenmarks, dem Hinterhorn, in sog. Laminae angeordnet sind. Die Entwicklung des dorsalen Horns und die zugrunde liegenden molekularen Steuerungsmechanismen sind bisher nicht vollständig untersucht. Mit Hilfe subtraktiver genomischer Screens konnten wir verschiedene Kandidatengene, wie den Homeobox-Transkriptionsfaktor Gbx1 und die Zinkfinger-Transkriptionsfaktoren Bcl11a und Bcl11b, mit bisher unbekannten Funktionen in der Entwicklung des dorsalen Horns identifizieren.
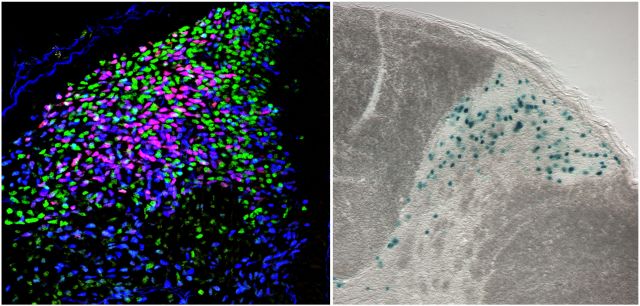
Gbx1 wird in einem Teil Lbx1+ Neurone des dorsalen Horns exprimiert und definiert eine bisher uncharakterisierte Population spät-geborener, Lhx1/5+, Pax2+, GABAerger Neurone (John et al., 2005). Die Funktionen Gbx1 exprimierender Nervenzellen im Rückenmark sind bisher nicht bekannt. Wir haben in unserer Arbeitsgruppe Gbx1 knock-out Mäuse erzeugt, die einen genetischen Reporter (IRESnlsLacZ) im Gbx1 Lokus tragen. Hierdurch können wir gezielt das Schicksal Gbx1 mutanter Nervenzellen im lebenden Organismus verfolgen und die Funktionen des Gbx1 Gens analysieren. Gbx1 und das nahe verwandte Gbx2 Gen sind während der Entwicklung dorsaler spinaler Neurone koexprimiert (John et al., 2005). Dies deutet darauf hin, dass beide Faktoren redundante Funktionen in dorsalen spinalen Neuronen besitzen. Wir beziehen daher Gbx1/2 Doppelmutanten in unsere Untersuchungen ein.
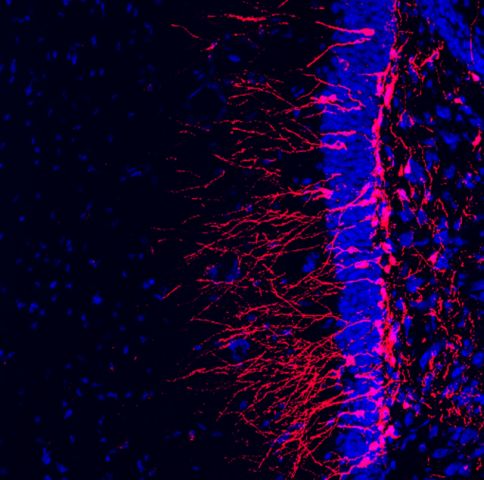
Bcl11a und Bcl11b kodieren für eng verwandte C2H2 Zinkfinger-Transkriptionsfaktoren, die im lympho-hämatopoetischen System exprimiert werden und dort essentiell sind für die Entwicklung von B- und T-Lymphozyten. Bcl11a und b sind darüber hinaus während der Entwicklung im Gehirn, im Rückenmark und im peripheren Nervensystem exprimiert. Ihre entwicklungsbiologischen Funktionen im Nervensystem sind bisher nur anfänglich verstanden. Wir haben ZNS-spezifische, konditionelle Mausmutanten für das Bcl11a und b Gen mit Hilfe der Cre-loxP Technologie erzeugt. Unsere Untersuchungen konnten zeigen, dass Bcl11a kritisch ist für die neuronale Differenzierung und Konnektivität im dorsalen spinalen Horn (John et al., 2007).
