Der
1. Hauptsatz setzt durch die
Energieerhaltung Grenzen, innerhalb derer ein
Prozeß ablaufen muß. Es gibt jedoch
Prozesse, die den Energieerhaltungssatz nicht verletzen würden, aber in der Natur nicht vorkommen. Bringt man z.B.
eine 300K warme Kugel in ein Gefäß mit 275K kaltem Wasser, so fließt solange
Wärme zum Wasser, bis beide
die gleiche
Temperatur haben:
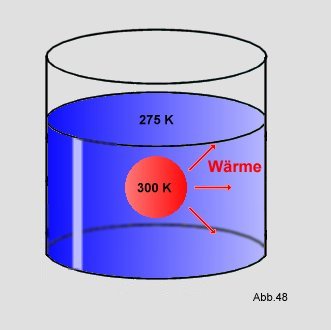
Es ist aber noch nie passiert, daß Wärme vom Kälteren zum Wärmeren fließt, was den
Temperaturunterschied noch vergrößern würde. Die 300K warme Kugel wird nicht auf 400K aufgeheizt, während das
Wasser auf 175 abkühlen müßte:
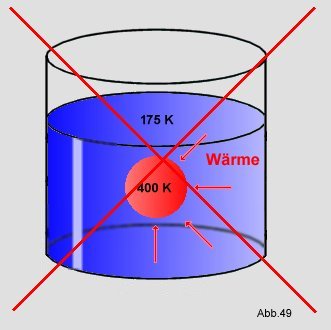
Als weiteres Beispiel kann man eine Teigkugel betrachten, die auf ein Brett fällt:
 Abb.50
Abb.50
Durch den Aufprall erwärmt sich die Kugel (von 293 K auf 298 K).
Es ist aber noch nie passiert, daß eine Teigkugel unter Abkühlung plötzlich nach oben springt:
 Abb.51
Abb.51
Das würde aber nicht dem 1. Hauptsatz widersprechen, da dieser nur aussagt, daß die Summe der Energien
immer gleich sein muß, und das wäre sie bei einem solchen Vorgang.
Um eine Aussage machen zu können, in welche Richtung ein Vorgang abläuft, wird eine Gleichung benötigt, die sich
nur auf den Anfangszustand eines
Systems
und den darauf ausgeübten Zwang bezieht.
Isolierte Systeme streben immer dem
Gleichgewicht zu. Dabei muss eine Größe die Antriebskraft sein. 1850 wurde sie
von
Clausius die
Entropie S genannt. Der
1. Hauptsatz beschreibt die Energiefunktion U und der 2. die Entropiefunktion. Genauso wie die innere Energie U
ist auch der 2. Hauptsatz eine Zustandsfunktion.
Die Gesamtentropie in einem isolierten System kann nie kleiner werden, d.h. sie kann nur größer werden oder
gleich bleiben. Ein System kann sich nicht mehr verändern, wenn die Entropie ihren
Maximalwert erreicht hat, das System befindet dann sich im Gleichgewicht.
In einem
geschlossenen System das im Gleichgewicht steht gilt:

Solch eine Reaktion muß unter totaler
Reversibilität ablaufen. Totale Reversibilität heißt, daß die Reaktion
unendlich langsam verlaufen muß, damit immer überall gleiche
Temperatur und
Drücke herrschen. Beispielsweise wirbeln
Gasmoleküle
in einem Gas, das expandiert wird, durcheinander und bilden Turbulenzen, sodaß die exakte Umkehr dieses
Prozesses unmöglich ist. Expandiert man dagegen unendlich langsam, sodaß sich keine Turbulenzen o.ä. bilden, dann
ist die Umkehr schon eher möglich.
Daran kann man sehen, daß eine reversible Reaktion einen Idealfall darstellt, der zwar manchmal fast
erreicht wird, aber in der Realität nie ganz erreicht werden kann.
Theoretisch wird die Reverisbilität jedoch behandelt. Man sagt, daß in einem geschlossenen System, in dem die
Temperatur und der Druck gleich bleiben, ein spontaner reversibler Ablauf folgende Entropieänderung hat:
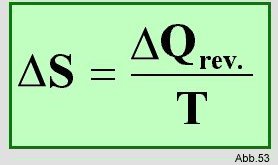
Bei der Temperatur T nimmt das System die Wärmemenge Q
rev. (=Wärmemenge bei reversiblem Prozeß) auf.
Daraus folgt, daß die Entropieänderung der Umgebung sich wie folgt definiert:

Alle Vorgänge können entweder als reversibel oder als
irreversibel eingeordnet werden. Irreversibel bedeutet, daß
der genaue Ablauf des Prozesses nicht mehr exakt umkehrbar ist. Bei diesen Vorgängen muß die Entropie immer
zunehmen, deswegen ist ihre Änderung wie folgt definiert :
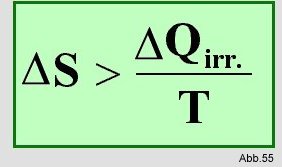
In einem geschlossenen System muß die Summe der Entropien des Systems und der Umgebung kleiner als 0 sein:

Der 2. Hauptsatz beschreibt die Richtung der Energieumwandlung. Wenn man z. B. einen fest verschlossenen
Behälter betrachtet, in dem zwei Gase eingeschlossen sind, dann werden sich diese Gase mit der Zeit
gleichmäßig durchmischen, d.h. einen Zustand größerer Unordnung und damit größerer Entropie einnehmen.
Der Zustand größerer Entropie ist also der wahrscheinlichere Zustand. Aus dem 2. Hauptsatz folgt, daß Wärme nicht
von einem Bereich mit niedriger Temperatur in einen Bereich mit höherer Temperatur übertragen werden kann, wenn
keine Arbeit verrichtet wird.
Perpetuum mobile:
Der 2. Hauptsatz hat noch eine Bedeutung für die Thermodynamik. Eine Maschine, die unter Verletzung des 2.
Hauptsatzes Arbeit verrichten würde, wird „Perpetuum mobile der 2. Art" genannt. Das wäre z.B. eine Wärmekraftmaschine,
die Wärme aus einer kalten Umgebung entnehmen könnte, um in einer warmen Umgebung Arbeit zu verrichten.
Laut dem 2.Hauptsatz ist dies aber unmöglich. Eine Maschine, die z.B. das Wärmereservoir der Meere in Arbeit
umwandelt kann also nicht existieren.
Von
Planck kam der Vorschlag diese Tatsache
"das Verbot des Perpetuum moblie 2.Art" zu nennen.
Geschichtliche Zitate:
Der Wissenschaflter
Sir Kelvin formulierte:
"Es ist unmöglich, eine zyklisch arbeitende Maschine zu konstruieren, die keinen anderen
Effekt hat, als die Entnahme von Wärme aus einem Behälter und die Verrichtung eines gleichen Betrages an Arbeit."
R.J.E. Clausius, 1854, Satz von der Vermehrung der Entropie:
"Bei jedem
natürlichen Vorgang nimmt die Entropie zu."
Außerdem stammt von ihm:
"Es ist nicht möglich eine zyklisch arbeitende Maschine zu konstruieren, die keinen
anderen Effekt produziert als die Übertragung von Wärme von einem kälteren auf einen wärmeren Körper."
und seine Zusammenfassung des 1. und 2. Hauptsatzes:
"Die Energie des Universums ist konstant, die Entropie des
Universums strebt immer einem Maximum zu, der 1. Hauptsatz ist Energieerhaltungssatz und deshalb ein
Symmetriegesetz. Der 2. ist kein Symmetriegesetz und er drückt ein Prinzip aus, das die Symmetrie des Weltalls
sprengt, indem es eine bestimmte Richtung seiner Veränderung fordert."