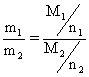Michael Faraday schrieb 1821 in seinen "Experimental-Untersuchungen über Elektrizität":
| § 360 | "Der allgemeine Schluss, welcher, wie ich glaube, aus der Summe
von Tatsachen gezogen werden muss, ist der, dass alle Elektrizität,
welcher Quelle sie auch entstammen mag, ihrem Wesen nach identisch
ist." (Anm.: Gemeint ist "atmosphärische Elektrizität", "Reibungselektrizität", "galvanische Elektrizität", "Thermoelektrizität" und "Induktionselektrizität", die in den vorausgehenden Paragraphen untersucht wurden.) |
||||||||||||||||||
| § 361 | "Nachdem ich die Identität hinlänglich sichergestellt glaubte, ging meine nächste Bemühung dahin, ein gemeinsames Maß oder eine bekannte Quantitätsbeziehung zwischen der durch eine Elektrisiermaschine erregten und der Elektrizität einer Voltaschen Säule zu erhalten." | ||||||||||||||||||
| § 377 |
Faraday findet, "dass die chemische wie die magnetische Kraft
direkt proportional ist der absoluten Quantität der durchgegangenen
Elektrizität." |
||||||||||||||||||
| § 504 | "Die Summe der chemischen Zusammensetzung ist konstant für jeden Querschnitt eines der Zersetzung unterliegenden Leiters von gleichförmiger Beschaffenheit, welchen Abstand auch die Pole von einander oder dem Querschnitt haben mögen." | ||||||||||||||||||
| § 505 | "Für eine konstante Quantität von Elektrizität ist bei jedem der Zersetzung unterliegenden Leiter, bestehe er aus Wasser, Salzlösungen, Säuren, geschmolzenen Körpern usw., auch der Betrag der elektrochemischen Aktion eine konstante Größe [...] das Agens, welches in dem, was wir elektrischen Strom nennen [... ist] vorhanden, [...] als die Achse einer aus entgegengesetzten, gerichteten Kräften bestehenden Gesamtkraft". | ||||||||||||||||||
| § 783 |
"Die chemische Kraft eines elektrischen Stromes ist direkt
proportional der absoluten Menge der durchgegangenen Elektrizität." |
||||||||||||||||||
| § 821 | liefert den Proportionalitätsfaktor aus Versuchen über
Äquivalenzmassen: "die mit irgend einer Substanz erhaltenen Resultate [stimmen nicht] bloß untereinander überein, sondern auch mit denen, welche andere Substanzen ergeben, so dass sich alles zusammen zu einer Reihe fester elektrochemischer Aktionen kombiniert." |
||||||||||||||||||
| § 836 | "Elektrochemische Äquivalente sind den gewöhnlichen
chemischen Äquivalenten gleich." Dies liefert obigen Proportionalitätsfaktor, indem Äquivalenzmasse und Ladung miteinander ins Verhältnis gesetzt werden. Das zweite Faradaysche Gesetz lautet in gebräuchlicher Formulierung: "Gleiche Elektrizitätsmengen scheiden verschiedene Stoffe im Verhältnis ihrer chemischen Äquivalentmassen ab."
Beide Gesetze lassen sich zusammenfassen:
Dies drückt den Erhalt von Ladung und Masse bei der Elektrolyse aus - allerdings lag diese Deutung Faraday fern. Er schloss nur: |
||||||||||||||||||
| § 869 | "die Äquivalentgewichte der Körper sind einfach diejenigen Mengen derselben, welche gleiche Mengen Elektrizität enthalten [...]; es ist die Elektrizität, welche die Äquivalentzahl bedingt [...]. Aber wenn wir die Atomtheorie und deren Terminologie annehmen, so sind es die in ihrer gewöhnlichen chemischen Aktion einander äquivalenten Atome der Körper, welche von Natur mit gleichen Mengen Elektrizität vereinigt sind. Aber ich muss gestehen, ich bin misstrauisch gegen den Ausdruck Atom, denn es ist sehr leicht, von Atomen zu reden, aber sehr schwierig, sich eine klare Vorstellung von ihrer Natur zu bilden, insbesondere wenn zusammengesetzte Körper in Betracht kommen." |