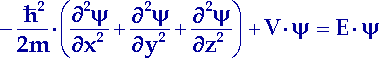
Nun wollen wir die Schrödinger Wellenmechanik auf die Elektronen in der Atomhülle anwenden. Im Unterschied zur kräftefreien Bewegung eines Elektrons in einem Potentialtopf wirkt die elektrostatische Anziehung des positiv geladenen Kerns auf die Elektronen in einem Atom. Die potentielle Energie der Elektronen ist nicht mehr gleich Null. Deshalb ist die Schrödinger-Gleichung für ein Elektron im Atomverband komplizierter als für ein freies Elektron in einem Potentialtopf:
| Dreidimensionale, zeitunabhängige Schrödinger-Gleichung | 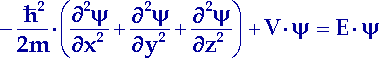
| (13.1) |
Dabei hängt die potentielle Energie des Elektrons nur von seinem radialen Abstand r zum Atomkern (Z: Kernladungszahl) ab:
| (13.2) |
| (13.3) |
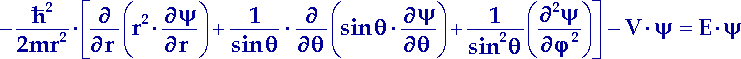
| (13.4) |
Zur Lösung einer Differentialgleichung dieser Art werden
die drei Variablen r, ![]() und
und ![]() getrennt, indem
die Wellenfunktion als Produkt von Funktionen der einzelnen Variablen geschrieben
wird:
getrennt, indem
die Wellenfunktion als Produkt von Funktionen der einzelnen Variablen geschrieben
wird:
| (13.5) |
Setzen wir diesen Separationsansatz für ![]() in die Gleichung (13.4) ein, dann können wir
daraus drei gewöhnliche Differentialgleichungen mit jeweils nur einer Variablen
erhalten: je eine Differentialgleichung für den Radialanteil R(r)
und die Winkelanteile
in die Gleichung (13.4) ein, dann können wir
daraus drei gewöhnliche Differentialgleichungen mit jeweils nur einer Variablen
erhalten: je eine Differentialgleichung für den Radialanteil R(r)
und die Winkelanteile ![]() (
(![]() )
und
)
und ![]() (
(![]() ).
Diese drei Gleichungen sind jedoch durch drei Konstanten, die sogenannten Separationskonstanten,
oder Quantenzahlen n, m
und l
miteinander verbunden.
).
Diese drei Gleichungen sind jedoch durch drei Konstanten, die sogenannten Separationskonstanten,
oder Quantenzahlen n, m
und l
miteinander verbunden.
Im Unterschied zu Quantenzahlen für ein Elektron im dreidimensionalen Potentialtopf hängen die Zahlen n, m und l voneinander ab, und zwar auf folgende Weise:
|
n = 1, 2, 3, ... l = 0, 1, 2, ..., (n - 1) m = - l, - (l - 1), ..., 0, ..., + (l - 1), + l | (13.6) |
Danach ist n eine beliebige natürliche Zahl, l ist eine ganze Zahl zwischen 0 und n - 1, und m nimmt ganzzahlige Werte von - l bis + l an.
Die Zahl n wird Hauptquantenzahl genannt. Sie hängt mit dem Radialanteil der Wellenfunktion R (r) zusammen und entspricht damit etwa der Zahl n im Bohrschen Atommodell. Die Hauptquantenzahl bezeichnet die Schale, zu der ein Elektron gehört.
Im Unterschied zum Bohrschen Atommodell ist eine Schale in der Wellenmechanik keine definierte Kreisbahn, sondern ein Bereich, in dem die Aufenthaltswahrscheinlichkeit eines Elektrons relativ groß ist.
Je größer n ist, umso weiter ist die Schale vom Atomkern entfernt und umso höher ist die Energie des Elektrons. Die Schalen werden oft wie Bohrsche Bahnen mit großen Buchstaben K, L, M, N usw. bezeichnet. Befindet sich z. B. das Elektron des Wasserstoffatoms in der K - Schale (n = 1), dann ist das Atom im Grundzustand: seinem energieärmsten Zustand.
Beim Wasserstoff hängt die Energie des Elektrons nur von der Hauptquantenzahl ab. Darum lässt sich sein Spektrum mit dem Bohrschen Atommodell einwandfrei erklären. Spektrale Untersuchungen von Atomen mit mehreren Elektronen zeigen jedoch kompliziertere Linienspektren. Hat ein Atom mehrere Elektronen, dann wechselwirken sie miteinander, ein zusätzliches elektrisches Feld baut sich auf. Die potentielle Energie von Elektronen hängt nicht mehr ausschließlich von ihrer Entfernung vom Kern, also von der Hauptquantenzahl ab, sondern kann auch in derselben Schale unterschiedliche Werte annehmen. Elektronen einer Schale können sich somit in unterschiedlichen, aber benachbarten Energieniveaus - Unterschalen - aufhalten. Jede Unterschale wird mit einer Nebenquantenzahl l oder mit einem Buchstaben bezeichnet:
|
l = Symbol: |
0, 1, 2, 3, 4, ... s, p, d, f, g, ... | (13.7) |
Die ersten vier Buchstaben stammen aus der Spektroskopie, einige Spektrallinien wurden früher mit englischen Adjektiven sharp, principal, diffuse, fundamental benannt. Ab l > 3 werden die Buchstaben alphabetisch fortgesetzt. Damit bekommt jede Unterschale einen einfachen und prägnanten Namen: Die Unterschale mit n = 1 und l = 0 wird 1s genannt; 2p steht für die Unterschale mit n = 2 und l = 1. Die Energie einer Unterschale wird von zwei Quantenzahlen bestimmt: n und l. Innerhalb einer Schale steigt die Energie der Elektronen mit zunehmender Nebenquantenzahl, also in der Reihenfolge: s < p < d < f ... Die Zahl der Unterschalen einer Schale ergibt sich aus der Anzahl der Nebenquantenzahlen und ist gleich n.
Wie können wir uns die Verteilung von Elektronen in einer Unterschale veranschaulichen?
Eine Unterschale wird durch die Quantenzahlen n und l bestimmt. Deswegen benötigen wir den Teil der Wellenfunktion, in dem nur diese zwei Quantenzahlen vorkommen, nämlich die radiale Funktion R (r). Die allgemeine Form einer normierten radialen Funktion sieht so aus:
| (13.8) |
Dabei sind r1 der erste Bohrsche Radius, N ein Normierungsfaktor und p(r) ein Polynom in r.
Nach der Bornschen statistischen
Interpretation ist die Wahrscheinlichkeit ![]() P,
dass ein Elektron in einem Volumen
P,
dass ein Elektron in einem Volumen ![]() V
zur Wirkung kommt, gleich dem Produkt aus dem Betragsquadrat seiner normierten
Wellenfunktion und
V
zur Wirkung kommt, gleich dem Produkt aus dem Betragsquadrat seiner normierten
Wellenfunktion und ![]() V:
V:
| (13.9) |
Die Verteilungsfunktion von Elektronen einer Unterschale darf
jedoch nur von einer Variablen abhängen, falls wir sie zweidimensional
darstellen wollen. Deshalb ersetzen wir in (13.9)
die normierte Wellenfunktion ![]() gegen ihren radialen Anteil R (r).
Da R (r)
eine reellwertige Funktion ist, kann sie selbst quadriert werden. Als
gegen ihren radialen Anteil R (r).
Da R (r)
eine reellwertige Funktion ist, kann sie selbst quadriert werden. Als ![]() V
nehmen wir eine dünne Kugelschale, ihr Volumen ist gleich dem Produkt aus
der Oberfläche der Schale 4
V
nehmen wir eine dünne Kugelschale, ihr Volumen ist gleich dem Produkt aus
der Oberfläche der Schale 4![]() r2
und ihrer Dicke
r2
und ihrer Dicke ![]() r.
Dann ist
r.
Dann ist ![]() P(r)
die radiale Aufenthaltswahrscheinlichkeit eines Elektrons:
P(r)
die radiale Aufenthaltswahrscheinlichkeit eines Elektrons:
| (13.10) |
und seine radiale Wahrscheinlichkeitsdichte, P(r), die gesuchte Verteilungsfunktion:
| (13.11) |
Im Diagramm links sehen wir die radialen Wahrscheinlichkeitsdichten für die Unterschalen 1s, 2s und 2p in einem Wasserstoffatom. Wir erkennen, dass ein Elektron der 1s-Unterschale seine größte Aufenthaltswahrscheinlichkeit beim ersten Bohrschen Radius hat. Falls ein Elektron sich in der 2s-Unterschale befindet, dann hat P(r) zwei Maxima. Das größte Maximum von 2s und das Maximum von 2p liegen in der Nähe vom zweiten Bohrschen Radius (4r1). Die Nullstelle von P(r) für 2s bedeutet, dass die Aufenthaltswahrscheinlichkeit eines 2s-Elektrons in einer Kugelschale um den Kern mit dem Radius 2r1 fast Null ist. Solche Kugelflächen werden Knoten-Kugelflächen genannt.
Die Quantenzahl l
erscheint außerdem auch im winkelabhängigen Teil der Wellenfunktion
![]() (
(![]() ).
Sie bestimmt den Betrag des Bahndrehimpulses L =
).
Sie bestimmt den Betrag des Bahndrehimpulses L =
![]() ,
der aus der Schrödinger-Gleichung errechnet wird. Die Nebenquantenzahl
l
heißt deswegen auch Bahndrehimpulsquantenzahl. Analog zum Drehimpuls
eines klassischen Teilchens können wir denken: Ein Elektron kreist um einen
Atomkern, sein Bahndrehimpulsvektor L steht senkrecht
auf der Rotationsebene. Das Elektron stellt somit einen elektrischen Strom dar
und erzeugt folglich ein magnetisches Feld. Bringen wir ein Atom in ein Magnetfeld,
dann versucht dieses äußere Feld die Ebenen der Elektronenbahnen
(ebenso wie die Stromschleifen eines Elektromotors) zu drehen. Je nachdem welche
Orientierungen die Rotationsebenen im Raum einnehmen, verändern sich die
Richtungen der Drehimpulsvektoren und damit auch die Energie der Elektronen.
,
der aus der Schrödinger-Gleichung errechnet wird. Die Nebenquantenzahl
l
heißt deswegen auch Bahndrehimpulsquantenzahl. Analog zum Drehimpuls
eines klassischen Teilchens können wir denken: Ein Elektron kreist um einen
Atomkern, sein Bahndrehimpulsvektor L steht senkrecht
auf der Rotationsebene. Das Elektron stellt somit einen elektrischen Strom dar
und erzeugt folglich ein magnetisches Feld. Bringen wir ein Atom in ein Magnetfeld,
dann versucht dieses äußere Feld die Ebenen der Elektronenbahnen
(ebenso wie die Stromschleifen eines Elektromotors) zu drehen. Je nachdem welche
Orientierungen die Rotationsebenen im Raum einnehmen, verändern sich die
Richtungen der Drehimpulsvektoren und damit auch die Energie der Elektronen.
Dieses Phänomen können wir in der Aufspaltung bestimmter
Spektrallinien (Zeeman-Effekt) beobachten. Einer Linie im Spektrum ohne
ein Magnetfeld entspricht ein Elektronenübergang aus einer bestimmten Unterschale
in eine andere. Im Magnetfeld erscheinen außer dieser Linie noch weitere
höher und tiefer liegende Linien. Die Energie der Unterschale spaltet sich
insgesamt in 2l + 1 Niveaus auf. Somit werden 2l + 1 bestimmte Orientierungen des Bahndrehimpulsvektors zum Magnetfeld
nachgewiesen. Jede dieser Orientierungen wird mit einer Magnetquantenzahl
oder Orientierungsquantenzahl m (von - l
bis + l)
charakterisiert. Das Bild links stellt die erlaubten Orientierungen des Drehimpulses
für l = 1 dar. Zeigt das Magnetfeld in z-Richtung,
dann gilt für die z-Komponente des Bahndrehimpulses:
![]() . Wegen der Unschärferelation
können wir nur eine Komponente des Drehimpulses exakt angeben. Die x-
und y-Komponenten sind unbestimmt. Die Vektoren
liegen an unbestimmten Stellen auf den Kegelmänteln um die z-Achse
und auf dem Kreis um den Ursprung.
. Wegen der Unschärferelation
können wir nur eine Komponente des Drehimpulses exakt angeben. Die x-
und y-Komponenten sind unbestimmt. Die Vektoren
liegen an unbestimmten Stellen auf den Kegelmänteln um die z-Achse
und auf dem Kreis um den Ursprung.
In Abwesenheit eines Magnetfeldes sind die Elektronen einer Unterschale nicht voneinander zu unterscheiden. Alle Richtungen des Bahndrehimpulsvektors sind energetisch gleichwertig. Deswegen haben die Elektronen einer Unterschale dieselbe Energie. Durch das Anlegen eines Magnetfeldes stellen wir fest: Elektronen einer Unterschale können sich in 2l + 1 unterschiedlichen Quantenzuständen aufhalten, jedem dieser Zustände entspricht eine bestimmte Wellenfunktion.
Die Wellenfunktionen von Elektronen in einem Atom werden Atomorbitale genannt. Die Atomorbitale beschreiben die räumliche Verteilung der Aufenthaltswahrscheinlichkeit eines Elektrons. Jedes Orbital wird durch drei Quantenzahlen n, l und m eindeutig gekennzeichnet. Die Anzahl der Orbitale in einer Unterschale l ist gleich 2l + 1. Die Magnetquantenzahl dient zur Unterscheidung der Orbitale einer Unterschale. Alle Orbitale einer Unterschale haben dieselbe Energie, sie sind entartet.
Wie können wir uns die Verteilung von Elektronen in Atomorbitalen veranschaulichen?
Atomorbitale werden grafisch meist durch Konturflächen der
Elektronendichte ![]() 2,
sogenannte Grenzflächendiagramme, dargestellt. Das sind Flächen
konstanten Wertes von
2,
sogenannte Grenzflächendiagramme, dargestellt. Das sind Flächen
konstanten Wertes von ![]() 2.
Sie begrenzen Raumbereiche, in denen sich ein Elektron mit einer bestimmten
Wahrscheinlichkeit (z. B. 90%) aufhält:
2.
Sie begrenzen Raumbereiche, in denen sich ein Elektron mit einer bestimmten
Wahrscheinlichkeit (z. B. 90%) aufhält:
In der Abbildung oben sehen wir, dass s-Orbitale eine kugelförmige Verteilung der Elektronendichte haben. Bei p-Orbitalen sind zwei Bereiche großer Aufenthaltswahrscheinlichkeit durch eine Knotenebene getrennt, die durch den Atomkern verläuft. Das Bild eines p-Orbitals erscheint wegen seiner Rotationssymmetrie wie eine Hantel mit zwei Kugeln auf den beiden Seiten der Knotenebene. Um die drei Orbitale einer p-Unterschale zu unterscheiden, werden sie rotationssymmetrisch bezüglich einer Achse des Koordinatensystems gezeichnet und nach ihren Rotationsachsen px-, py- bzw. pz-Orbital genannt. Die Grenzflächendiagramme von d-Orbitalen haben zwei Knotenebenen. Sie besitzen (außer dem dz2-Orbital) eine rosettenförmige Gestalt. Die Nebenquantenzahl l gibt also die Anzahl der Knotenebenen an und bestimmt damit die Form der Orbitale. Die Kenntnis der Orbitalstruktur von Atomen und Molekülen ist notwendig für das Verständnis chemischer Bindungen.