Seite - 4 -
| I. Grundlagen der Thermodynamik |
 Definitionen: Definitionen:
Aggregatszustände:
Es gibt drei sog. Aggregatszustände, nämlich gasförmig, flüssig und fest. Der einfachste davon ist gasförmig.
Je nach Temperatur und Druck sind sie ineinander
umwandelbar. Bei welcher Temperatur ein Stoff z.B. fest ist, hängt von seiner Struktur ab und von den
Anziehungskräften zwischen den einzelnen Teilchen (z.B. Atomen). So ist z.B.
ein Stoff, bei dem die einzelnen Teilchen eine sehr größe Anziehungskraft aufeinander ausüben, auch bei hohen
Temperaturen noch fest, ein Stoff jedoch bei dem es kaum Anziehung gibt (wie z.B. bei den Edelgasen Helium, Neon,
Argon, Krypton, Xenon und Radon), ist sogar fast bis zum absoluten Nullpunkt noch
gasförmig.
Wasser z.B. ist unter halb von 0°C fest (Eis), oberhalb davon bis 100°C flüssig und danach dann gasförmig.
Systeme:
Möchte man die thermodynamischen Gesetze anwenden, muss man vorher festlegen, welchen Bereich oder Ausschnitt man
betrachtet. Es werden Ansammlungen von Materie und Energie in einem bestimmten Rahmen
untersucht. Dieser Rahmen muß
nicht wirklich vorhanden sein, es reicht auch, wenn es sich dabei nur um gedachte Linien handelt. Dies wird
dann als System bezeichnet. Alles was außerhalb des festgesteckten Rahmens des Systems liegt, wird Umgebung
genannt.
Die einzelnen Teile eines Systems müssen mindestens Wärme miteinander austauschen
können. So kann es sich dabei
zum Beispiel um ein Reagenzglas handeln, um einen Dampfdrucktopf oder aber auch um das gesamte Universum. Wichtig
ist nur, dass man vorher definiert in welchem Bereich man die einzelnen Variablen (wie
Druck, Temperatur und Volumen) mißt, bzw. ändert.
In der Thermodynamik untersucht man nun die Änderungen der Energieverteilung, wenn
man ein System von einem bestimmten Zustand in einen anderen bringt, bzw. wenn sich von selbst ein Gleichgewichts-
oder Endzustand einstellt.
Man unterscheidet Systeme wie folgt :
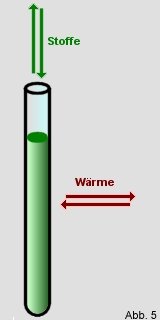
Offenes System:
Bei einem offenen System
legt man einen Bereich fest, der weiterhin mit seiner Umgebung in
Kontakt steht. Es ist also möglich Stoffe bzw. Materie
auszutauschen, sowie auch Energie
(z.B. Wärme). Ein Beispiel
hierfür ist ein Reagenzglas, das mit einem Stoff gefüllt und
oben offen ist. Betrachtet man nun dieses System, muss man bedenken,
dass weiterhin Stoff nach oben entweichen, bzw. aus der Luft in das
Glas gelangen kann. Außerdem entweicht Wärme, oder wird
Wärme aufgenommen, je nachdem welcher Bereich kälter bzw.
wärmer ist. Auch der Mensch ist ein offenes System, er nimmt
ständig Materie auf (z.B. Sauerstoff) und gibt auch wieder welche
ab (z.B. Kohlendioxid). Genauso verliert er Wärme wenn es kalt um
ihn herum ist oder er heizt sich in der Sonne auf. |
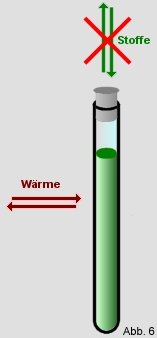
Geschlossenes System:
Ein geschlossenes System
ist, wie der Name schon sagt, geschlossen. Das bedeutet, dass kein
Stoff- bzw. Materieaustausch mit der Umgebung mehr möglich ist.
Die Menge innerhalb dieses Systems bleibt gleich. Dies erreicht man
dadurch, dass man z.B. einen Stöpsel auf das Reagenzglas,
oder einen Deckel auf den Topf setzt, oder eben gleich ein System
betrachtet, dass schon geschlossen ist. Bei dem Verschluß sollte
allerdings gewährleistet sein, daß er luftdicht ist, ansonsten
wäre Stoffaustausch möglich. Besonders sicher ist
es, wenn man z.B. das Reagenzglas zuschmiltzt. Die Energie (z.B. Wärme) kann im geschlossenen System
jedoch weiterhin in das System ein-, bzw. aus dem System heraustreten.
Ein Wärmeaustausch bei einem geschlossenen Reagenzglas ist also
weiterhin möglich. |
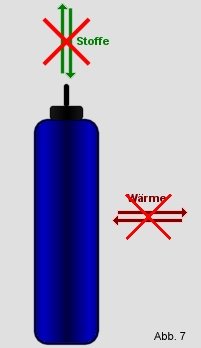
Isoliertes System:
Ein isoliertes System läßt weder
Materie noch Energie entweichen. Auch
die Aufnahme ist nicht möglich. Zum Beispiel eine Thermoskanne,
aus ihr können weder Stoffe, noch Wärme entweichen oder eindringen. Ein
kaltes Getränk bleibt kalt und ein Warmes warm. Ein weiteres
Beispiel für ein isoliertes System ist das gesamte Universum, da
aus ihm auch nichts entweichen kann, bzw. etwas außerhalb davon
eindringen kann. |
Gleichgewichtszustände:
 Ändert sich in einem System nach langer Zeit (und ohne äußere
Einflüsse), keine Zustandsgröße, so
spricht man von einem Gleichgewichtszustand. Da nur in einem isolierten System von außen keine Beeiflussung kommen
kann, ist es nur in diesem Fall möglich einen
Gleichgewichtszustand zu bekommen. Die Temperatur aller einzelnen Teile des System
ist in diesem Fall gleich und beim Druck
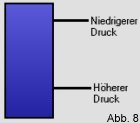
wird das genauso angenommen. In einem hohen Behälter ist der
Druck zwar unten höher als oben (siehe Bild), es liegt jedoch ein
Gleichgewichtszustand vor, da sich der Druck nicht ändert, sonder
das Druckgefälle konstant beibehält, solange kein
äußerer Einfluß diesen verändert. Da viele
Veränderungen nur sehr langsam ablaufen, kann es sein, dass
ein Gleichgewicht nur vorgetäuscht ist, auch wenn sich
während einer langen Zeit keine Zustandsgrößen geändert
haben.
Zustandsgrößen:
Möchte man ein System beschreiben, braucht man dafür Größen. Da es egal ist, auf welchem Weg die
Werte der einzelnen Größen entstanden sind, und sie nur von dem jeweiligen betrachtetem Zustand abhängen, nennt man
diese Größen Zustandsgrößen. In der Thermodynamik beschreibt man ein System z.B. durch die Zustandgrößen:
Druck p, Volumen V, Stoffmenge n
, und Temperatur T.
Zustandsgrößen werden in zwei Gruppen eingeteilt :
intensive: Sie sind von der Stoffmenge unabhängig. Das bedeutet, wenn man z.B. 5 mol des Stoffes aus dem
System entfernt, behalten sie trotzdem den gleichen Wert bei. Intensive Größen sind die Temperatur und der Druck.
Entfernt man z.B. 5 mol eines 25°C warmen Gases, dann ist der Rest immer noch 25°C warm.
extensive: Diese Größen sind von der Stoffmenge abhängig, d.h. wenn man die Menge z.B. um die Hälfte
reduziert, dann ändern sich ihre Werte auch entsprechend. Extensive Größen sind das Volumen, die Stoffmenge und
die Masse.
Teilt man extensive Größen durch die Stoffmenge, erhält man intensive Größen. Das Volumen z.B. geteilt durch die
Stoffmenge, ist V/n und heißt Molvolumen.
Um ein System beschreiben zu können, benötigt man mindestens eine intensive und eine extensive Größe.
Zustandsgleichung:
Verändert man in einem System eine Zustandsgröße, dann ändern sich auch
eine oder mehrere der anderen. Das wird durch eine sog. Zustandsgleichung ausgedrückt, die die Zusammenhänge
zwischen den einzelnen Zustandsgrößen Druck p,
Volumen V, Temperatur T und
Stoffmenge n beschreibt. Ein Beispiel hierfür sind die Gasgesetze von
Gay-Lussac und Boyle-Mariotte. Die Abhängigkeiten
zwischen den Zustandsgrößen werden oft in sog. Zustandsdiagrammen dargestellt.
Auch die innere Energie U ist eine Zustandsgleichung (siehe 1. Hauptsatz).
Wenn ein geschlossenes System (mit konstantem Druck und
konstanter Temperatur) aus einem Zustand A in einen Zustand B übergeht, so ist die Änderung der inneren Energie
DU immer gleich groß, egal auf welchem noch so kompliziertem Weg der Zustand B erreicht
wurde.
thermodynamische Prozesse:
Thermodynamische Prozesse sind die Abläufe, die in einem System passieren, wenn sich eine oder
mehrere Zustandsgrößen verändert haben bzw. verändert wurden. Meistens zwingt man dabei eine der
Größen dazu gleich zu bleiben. Da es drei Größen gibt, die sich gegenseitig beeinflussen
( Druck p, Volumen V und
Temperatur T) kann man so direkt sehen, wie sich die veränderte Größe nur auf eine der
anderen auswirkt und dabei gegebenenfalls mathematische Zusammenhänge herausfinden.
Die Prozesse werden, je nachdem welche der drei Größen konstant gehalten wird, eingeteilt in:
- isotherm: Die Temperatur des Systems wird gleich gehalten
- isobar: Der Druck bleibt gleich
- isochor: Das Volumen bleibt gleich
Außerdem gibt es noch thermodynamische Prozesse, die adiabatisch genannt werden. Bei ihnen bleibt die
Wärmeänderung DQ gleich Null.
Ein weitere Einteilung macht man, je nachdem auf welchem Weg man von einem Zustand zum anderen gelangt:
- reversible Prozesse: Das ist ein Prozess, bei dem während des Übergangs
nur lauter Gleichgewichtszustände durchlaufen werden. Das bedeutet, daß der Prozeß in
all seinen einzelnen Zuständen exakt umkehrbar sein muß.
- irreversible Prozesse: So nennt man Prozesse, die nicht nur
Gleichgewichtszustände druchlaufen. Das bedeutet, daß sie nicht exakt umkehrbar sind.
In der Natur nicht gibt es keine exakt reversiblen Prozesse, ein Gas z.B. kann nur sehr schwer reversibel
ausgedehnt werden, weil bei diesen Vorgang viele Turbulenzen und Wirbel auftreten und es unmöglich ist, diese
bei der Umkehrung exakt wieder zu erhalten. Läßt man das Gas jedoch undendlich langsam ausdehnen, erreicht man, daß
es beim umgekehrten Vorgang fast exakt die gleichen Zustände durchläuft, es also nahezu reversibel
ausgedehnt wurde.
Zustandsdiagramm:
In einem Zustandsdiagramm wird grafisch dargestellt, wie sich ein Stoff in Abhängigkeit der
einzelnen Zustandsgrößen z.B. Druck p, Volumen V und
Temperatur T verhält. Da dies bei drei Größen ein dreidimensionales Bild ergibt, setzt man
häufig eine der drei Größen konstant, so entsteht z.B. das Phasendiagramm, indem das Volumen konstant ist, und die
verschiedenen Zustände eines Stoffes nur noch durch Druck und Temperatur beschrieben werden:
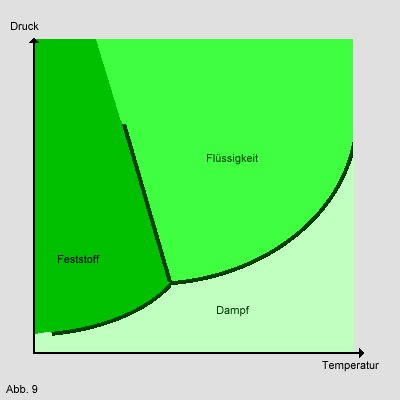
Aus einem solchen Diagramm kann man ablesen, bei welchen Druck/Volumen-Paaren ein Stoff fest,
flüssig bzw. gasförmig ist. Weggrößen:
Im Gegensatz zu den Zustandsgrößen, hängt bei den Weggrößen der Wert vom Ausgangs-, vom Endzustand des Systems und
vom Weg ab, auf dem das System in den vorliegenden Zustand gekommen ist. Ein Beispiel hierfür ist die
Arbeit, die an einem System verrichtet wird, um zu einen Zustand zu gelangen.
|
 |
 |
 |
| Was ist Thermodynamik? |
Geschichte der Thermodynamik |
Definitionen |
|
|
|
nächstes Kapitel |
|

|
 |
|
|
 |