A
absoluter Nullpunkt:
absolute Temperatur:
Analyse
[griechisch: analysis "Auflösung"]
Die Aufgliederung eines Ganzen in seine Bestandsteile; genaue
Untersuchung der Einzelteile;
qualitative Analyse: Bestimmung der Art der Bestandsteile eines Stoffgemisches.
quantitative Analyse: Bestimmung der Menge der Bestandteile in einem Stoffgemisch.
Analytik:
Die Lehre bzw. das Verfahren der Analyse.
Arbeit:
Abkürzung: W
Die Arbeit W ist das Produkt aus der Kraft, die an einem Körper angreift und dem Weg, der in
Kraftrichtung zurückgelegt wird. Die Kraft wird F genannt und der Weg s:
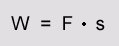
Die Arbeit wird in Joule J gemessen. [1J = 1 Nm (Newtonmeter) = 1 Ws (Wattsekunde)]
 Aristoteles:
Aristoteles:
Aristoteles war ein griechischer Philosoph und Wissenschaftler. Er lebte von 384-322 v. Chr. Mit 17 wurde er
Schüler des berühmten Philosophen Platon. Mit 35 hat er die
peripatetische Schule in Athen gegründet. 2 Jahre später wurde er Lehrer von Alexander dem Großen.
Seine Werke umfassen die Gebiete der Physik, Politik, Tiergeschichte, Ethik und Poethik.
atm:
Abkürzung für die seit dem 1. 1. 1978 nicht mehr
zulässige Druckeinheit "physikalische Atmosphäre".
Heute ersetzt durch die Einheit Bar: 1 atm = 1,013 bar.
Atom:
Abb.64

[griechisch: atomos "unteilbar"; a "nicht" + tome "Schnitt"]
Der erste, der diesen Namen benützte, war der griechische Philosoph Demokrit. Er bezeichnete damit ein nicht weiter zerlegbares Materieteilchen.
Heute versteht man unter einem Atom das kleinste, mit chemischen Mitteln nicht mehr spaltbares Teilchen eines chemischen Elements.
Das Atom ist jedoch mit physikalischen Mitteln, die energiereicher sind als chemische, weiter zerlegbar in Ionen und Elektronen (und diese dann weiter in Neutronen, Protonen und sogar Quanten).
Diese einzelnen Bestandteile haben jedoch dann nicht mehr die charakteristischen chemischen Eigenschaften des jeweiligen Elements zu tun.
Atome haben einen Durchmesser von etwa 10-8 cm und bestehen aus einem positiv geladenen Kern und einer Hülle aus negativ geladenen Elektronen.
Der Kern ist ca. 10-12 cm groß und enthält fast die ganze Masse des Atoms, da die Elektronen im Verhältnis kaum etwas wiegen.
Das Atom ist nach außen neutral geladen, da sich die positive Kernladung und die negative Ladung der Elektronen aufheben.
Kern und Elektronen werden durch die elektrischen Anziehungskräfte zwischen den verschiedenen Ladungen zusammengehalten.
Die Elektronen sind in einzelnen "Schalen” angeordnet. Voll aufgefüllte Schalen sind besonders stabil.
Allein die Elektronen der äußersten nicht abgeschlossenen Schale bestimmen das chemische Verhalten eines Atoms. Dadurch wird die Anordnung der chemischen Elemente zu einem
Periodensystem erklärt, in dem Gruppen von Elementen ähnliche chemische Eigenschaften haben.
Gibt ein Atom ein oder mehrere Elektronen ab, so entsteht ein positiv geladenes Ion, nimmt es welche auf, entsteht ein negativ geladenes Ion.
Nach dem Atommodell von Bohr und Sommerfeld (1915) kreisen die Elektronen auf ganz bestimmten Ellipsenbahnen um den Kern. Dieses Modell erklärt jedoch nicht alle experimentellen Tatsachen.
Nach neueren Kenntnissen, kann man sich die Elektronen als Ladungswolken um den Kern verteilt denken.
Graf Avogadro di Quaregna e Ceretto, Amadeo:
Italienischer Physiker, * 9. 8. 1776 in Turin, † 9. 7. 1856 in Turin.
Er war Professor in Turin. Er stellte das nach ihm benannte Gesetz (Avogadro'sches Gesetz) auf,
nach dem bei gleichem Druck und gleicher Temperatur alle Gase mit
dem gleichen Volumen auch die gleiche Anzahl von Molekülen enthalten. Diese Regel gilt nur
für ideale Gase.
Bei Normalbedingungen (0° C und 1013 bar Druck) befinden sich in einem Liter eines Gases 2,687 * 1019 Moleküle (Avogadro'sche Zahl).
Außerdem stellte er fest, daß ein mol eines idealen Gases 22,4 Liter einnimmt.
B
bar:
[griechisch. baros "Schwere" bzw.griechisch barys, "schwer”]
Zeichen: bar; Maßeinheit des Drucks (Luftdrucks)
Der normale Luftdruck beträgt 1,013 bar.
1 bar = 105 Pa (Pascal). Gebräuchlich ist auch Millibar: 1 mbar = 1/1000 bar = 100 Pa = 1 hPa (Hektopascal).
Black, Joseph:
Britischer Arzt und Chemiker, * 16. 4. 1728 in Bordeaux, † 6. 12. 1799 in Edinburgh.
Er entdeckte, daß beim Erhitzen von Kalkstein und Magnesiumcarbonat Kohlendioxid (damals "fixe Luft” genannt) entweicht. Außerdem beobachtete
er als Erster, daß bei chemischen Reaktionen Gewichtsverluste auftreten.
Er war außerdem einer der Ersten, die den Unterschied zwischen der extensiven
Größe Wärme und der intensiven
Größe Temperatur betonte und veranschaulichte.
Boltzmann, Ludwig Eduard:
Österreichischer Physiker, * 20. 2. 1844 in Wien, † 5. 9. 1906 in Duino, Görz.
Er entwickelte an der kinetischen Gastheorie, indem er die Gesetze der Statistik auf die Gasmoleküle
anwendete. Außerdem entdeckte er
die Beziehung zwischen der Entropie und der Wahrscheinlichkeit.
C
Carnot, Nicolas Léonard Sadi:
Französischer Physiker, * 1. 6. 1796 in Paris, † 24. 8. 1832 in Paris.
Er machte viele Beiträge zur Thermodynamik, unter anderem den sog. Carnot'schen Kreisprozess.
Carnot´scher Kreisprozeß:
Eine Wärmekraftmaschine, die Arbeit
vollständig in Wärme umwandeln würde, wäre fähig einen idealen Kreisprozeß auszuführen. Sie hätte damit einen Wirkungsgrad von 1. Im 19. Jh. jedoch wurde von Sadi Carnot
bewiesen, daß es eine solche Maschine nicht geben kann (siehe u.a. 2. Hauptsatz), denn jede Maschine muss einen Teil der zugeführten Wärme als Abwärme abführen. Die Grenze für den Wirkungsgrad einer Maschine liegt unter 1, dieser Grenzfall wird Carnot´scher Kreisprozeß genannt.
 Celsius, Anders:
Celsius, Anders:
Schwedischer Astronom, * 27. 11. 1701 in Uppsala, † 25. 4. 1744 in Uppsala
Er wurde bekannt durch seinen Vorschlag (1742) die Skala des
Thermometers in 100° einzuteilen (Celsiusskala).
Clausius, Rudolf Julius Emanuel:
Deutscher Physiker, * 2. 1. 1822 in Köslin, † 24. 8. 1888 in Bonn
Er entwickelte die kinetische Gastheorie weiter und fand 1850 den 2. Hauptsatz der Thermodynamik.
Außerdem führte er 1865 den Begriff der Entropie ein.
D
 Dalton, John:
Dalton, John:
Englischer Chemiker und Physiker, * 5. oder 6. 9. 1766 in Eaglesfield, Cumberland, † 27. 7. 1844 in Manchester.
Er begründete die Atomtheorie. Außerdem beschrieb er das Gesetz der multiplen Proportionen,
nach dem die Gewichtsverhältnisse zweier oder mehrerer verschiedener Verbindungen derselben chemischen Elemente im Verhältnis einfacher ganzer Zahlen zueinander stehen.
Er formulierte zudem das Dalton'sche Gesetz, nach dem der Druck eines idealen Gasgemisches gleich der Summe der Drucke der einzelnen Bestandteile des Gemisches ist.
Druck:
Abkürzung: p
Der Druck ist das Verhältnis der Kraft F zur Fläche A, auf die sie wirkt: p = F/A.
Der Druck bei Flüssigkeiten und Gasen wird in der Einheit Bar gemessen.
Der Gasdruck ensteht durch den Aufprall vieler Gasmoleküle auf die Wände des Behälters/Raumes.
E
empirisch:
Auf Erfahrung beruhend, aus Erfahrung gewonnen
Energie:
[griechisch]
Ursprünglich nannte man so die Fähigkeit eines Körpers Arbeit zu leisten.
Jeder Körper hat aufgrund seiner Lage und seiner Bewegung in Bezug auf andere Körper eine Lageenergie (potentielle Energie: z.B. kann ein angehobener Körper durch seinen Fall Arbeit leisten) und eine Bewegungsenergie (kinetische Energie: z.B. ein fahrender Bus).
Dieses sind aber nur mechanische Energien. Robert Mayer entdeckte, daß diese Energien aber auch vollständig in Wärme, eine andere Energieform, umgewandelt werden können.
Aufgrunddessen fand er den Satz von der Erhaltung der Energie, nachdem die Summe der Energien in einem isolierten System
immer gleich sein muss, was weiter bedeutet, daß Energie weder aus nichts hergestellt noch zerstört werden kann (siehe 1. Hauptsatz).
Heute wird Energie als eine messbare Größe definiert, die unterschiedlich auftreten kann. Es gibt z.B. auch elektrische, magnetische, Ruheenergie und Kernenergie.
Die Maßeinheiten der Energie sind: Joule J, Kilowattstunde kWh und Elektronenvolt eV.
F
Fahrenheit:
Zeichen: °F
Maßeinheit einer Temperaturskala, deren Nullpunkt bei -17,78°C liegt. 0°C = + 32°F, 100°C = 212°F [nach dem Physiker Daniel Gabriel Fahrenheit, 1686-1736]
Fahrenheit, Daniel Gabriel:
Deutscher Physiker, * 14. 5. 1686 in Danzig, † 16. 9. 1736 in Den Haag.
Er führte Quecksilberfüllungen und die nach ihm benannte Gradeinteilung, Grad Fahrenheit °F, für Thermometer ein.
Ferchault de Réaumur, René-Antoine:
Französischer Physiker und Zoologe, * 28. 2. 1683 in La Rochelle, † 17. 10. 1757 in Gut Bermondière (Maine, USA).
Er untersuchte u.a. die Wirkung von Wärme auf die Insektenentwicklung. 1730 führte er beim Thermometer die Réaumurskala ein.
 Baron De Fourier, Jean Baptiste Joseph:
Baron De Fourier, Jean Baptiste Joseph:
Französischer Mathematiker und Physiker, * 21. 3. 1768 in Auxerre, † 16. 5. 1830 in Paris.
Er veröffentlichte eine mathematische Theorie der Wärmefortpflanzung (Fouriersche Reihen).
G
Gas:
[griechisch. chaos ]
Aggregatzustand eines Stoffes, in dem die einzelnen Teilchen (Moleküle, Atome) freie Beweglichkeit haben. Deswegen hat es keine bestimmte Gestalt, sondern nimmt jeden Raum ein, in den es gebracht wird und füllt
diesen vollständig aus, so daß jedes einzelne Teilchen seine größtmögliche Bewegungsfreiheit hat. Bringt man ein Gas in einen größeren Behälter, so verteilt es sich wieder vollständig, allerdings sinkt dann die Dichte.
Die Teilchen stossen ständig gegen die Raumwände, was als Druck des Gases bezeichnet und gemessen wird.
Jeder Festkörper bzw. jede Flüssigkeit kann bei genügend hoher Temperatur (Siedepunkt) in ein Gas verwandelt werden.
Auch lässt sich jedes Gas bei genügend großem Druck und genügend niedriger Temperatur, in eine Flüssigkeit verwandeln (Gasverflüssigung).
Jedes Gas übt auf die Wände des umgebenden Raums einen Druck aus, der bei Verkleinerung des Raumes ansteigt. Den Zusammenhang zwischen Volumen, Druck und Temperatur eines Gases gibt die
Zustandsgleichung an.
Alle Gase sind unbegrenzt miteinander mischbar, dabei verhält sich jedes Gas so, als ob ihm der gesamte Raum allein zur Verfügung stehen würde.
Der Gesamtdruck dieser Mischung ist gleich der Summe der einzelnen Drucke.
Die nur in der Theorie exisierenden idealen Gase folgen der allgemeinen Gasgleichung.
Die in der Praxis vorkommenden realen Gase weichen vom idealen Verhalten mehr oder weniger stark ab, am wenigsten bei höheren Temperaturen und niedrigen Drucken. Ihr Verhalten wird durch kompliziertere Zustandsgleichungen wiedergegeben.
Gas, permanentes:
Die Bezeichnung ist veraltet, man benannte damit früher Gase, die
in keinen der anderen Aggregatszustände (flüssig oder fest) überführt werden konnten. Zu dieser Erkenntnis gelangte man, weil
damals alle Versuche, diese Gase durch Druck zu verflüssigen, fehlschlugen, obwohl man Drücke von mehreren
tausend bar anwandte. Heutzutage ist dies allerdings kein Problem mehr, weswegen es diese Bezeichnung
nicht mehr gibt.
Zu den permanenten Gases zählten z.B.: Sauerstoff (O2),
Wasserstoff (H2)
und Stickstoff (N2).
H
von Helmholtz, Hermann Ludwig Ferdinand:

Deutscher Mediziner und Naturwissenschaftler, * 31. 8. 1821 in Potsdam, † 8. 9. 1894 in Berlin-Charlottenburg.
Er war Professor in Königsberg, Bonn, Heidelberg und (seit 1871) Berlin. Er vertiefte die Begründung des Energieerhaltungssatzes
in seiner Arbeit "Über die Erhaltung der Kraft” (1847).
Er maß die Fortpflanzungsgeschwindigkeit eines Nervenreizes (rund 120 m/s) und erfand viele Instrumente zur Untersuchung von Augen (Augenspiegel) und Ohren.
Außerdem verfasste er Theorien über Sehen (Dreifarbenlehre) und Hören (Kombinationstöne).
Er erkannte das Elektron als elektrisches Elementarteilchen.
Helmholtz war Mitgründer und erster Präsident der Physikalisch-Technischen Reichsanstalt und beeinflusste Naturwissenschaft und Technik seiner Zeit stark.
I
irreversibel:
[frz. irréversible "nicht umkehrbar"; zu lat. revertere "umkehren"]
nicht umkehrbar, nicht mehr rückgängig zu machen, nur in einer Richtung verlaufend.
Gegenteil: reversibel
Reversibler Prozeß: Vorgang bei dem alle Zwischenzustände Gleichgewichte sind.
Irreversibler Prozeß: Vorgang, der nicht mehr exakt umkehrbar ist.
Typisch irreversibel sind z.B. die Ausdehnung eines Gases ins
Vakuum oder die Ausfällung eines edleren Metalls durch ein weniger Edles aus seiner Lösung.
J
Joule, James Prescott:
Englischer Physiker, * 24. 12. 1818 in Salford, Manchester, † 11. 10. 1889 in Sale, London.
Er trat als einer der ersten für den Satz von der Erhaltung der Energie ein.
Er bestimmte quantitativ die Gleichwertigkeit zwischen mechanischer Energie und Wärme. 1841 formulierte er das Joule'sche Gesetz,
das besagt, daß die Wärme, die in einem stromdurchflossenen Draht entsteht,
der Größe des Widerstands (R), der Zeit (t) und dem Quadrat der Stromstärke (I) proportional ist: Q = R * t * I2. Mit William Thomson zusammen
entdeckte er den Joule-Thomson-Effekt.
K
Kraft:
Die Kraft ist eine Größe, die die Bewegung eines Körpers in der Richtung zu verändern bestrebt ist.
Das Produkt aus Kraft F in Wegrichtung und zurückgelegtem Weg s heißt Arbeit W (W = F*s).
Der Quotient aus der senkrecht auf eine Fläche A wirkenden Kraft F und dieser Fläche heißt Druck p
(p = F/A).
Zwei oder mehrere Kräfte, die im selben Punkt eines Körpers angreifen, wirken insgesamt als resultierende Kraft.
Da die Kraft ein Vektor ist (sie hat einen Betrag und eine Richtung), ergibt sich die Gesamtgröße und Richtung der Gesamtkraft aus dem Vektordiagramm der Kräfte: Man trägt die in jeder Richtung wirkende Kraft als Pfeil auf Papier auf, wobei die Länge des Pfeils der Größe der Kraft entspricht.
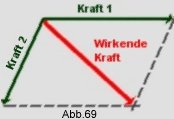 Je zwei solcher Pfeile (Vektoren) bilden zwei Schenkel eines Parallelogramms (Kräfteparallelogramm), dessen Diagonale die für die beiden Kräfte resultierende Kraft nach Größe und Richtung angibt.
Je zwei solcher Pfeile (Vektoren) bilden zwei Schenkel eines Parallelogramms (Kräfteparallelogramm), dessen Diagonale die für die beiden Kräfte resultierende Kraft nach Größe und Richtung angibt.
Greifen 2 gleich große, entgegengesetzt gerichtete Kräfte an verschiedenen Punkten desselben Körpers an, so bilden sie ein Kräftepaar, das keine fortschreitende, sondern eine Drehbewegung des Körpers verursacht.
In der technischen Mechanik unterscheidet man äußere Kräfte, die eine Beschleunigung herbeiführen oder ihr entgegenwirken (z.B. Gewicht; Reibungs-, Trägheitswiderstand), und innere Kräfte, die nur Formänderungen bewirken (z.B. Kräfte auf Träger).
Bei der gegenseitigen Anziehung zweier Massen ist die Gravitationskraft, bei der Anziehung zweier Ladungen die Coulomb'sche Kraft (Coulomb).
Die Einheit der Kraft ist 1 Newton. Ein Newton (1 N) ist die Kraft, die der Masse 1 kg die Beschleunigung 1 m/s2 erteilt :
1 N = 1 kg*m/s2
Kelvin:
Sir Kelvin, William Thomson, Lord of Largs:
Britischer Mathematiker und Physiker. * 26. 6. 1824 in Belfast, † 17. 12. 1907 in Netherhall bei Largs (Schottland).
Präsident der Royal Society (1890-1895).
Er arbeitete auf allen Gebieten der Physik und definierte die Kelvin-Skala (die Skala der absoluten Temperatur).
L
Maquis de Laplace, Pierre Simon:

Französischer Mathematiker und Astronom, * 28. 3. 1749 in Beaumont-en-Auge, † 5. 3. 1827 in Paris.
Er war unter Napoleon I. Kanzler des Senats. Außerdem hat er die klassischen Werke "Système du monde” 1796 und "Mécanique céleste” (in 5 Bänden) 1799-1825 verfasst.
Er stellte die Nebularhypothese über die Entstehung des Planetensystems auf. Sie besagt, daß sich aus einer in Rotation
befindenden gasförmigen Urmaterie wegen der Fliehkraft Teile abspalten, aus denen dann die Planeten entstanden.
Zudem wies er die Unveränderlichkeit der Planetenbahnen und damit die Stabilität eines Planetensystems nach.
In der Mathematik begründete er die Theorie des Potentials, der Kugelfunktionen und entwickelte die
Wahrscheinlichkeitsrechnung.
Logarithmus:
Abkürzung: log (Zehnerlogarithmus)
Möchte man in einer Gleichung der Form 10b = c wissen, welchen Zahlenwert b hat,
erreicht man das durch logarithmieren auf beiden Seiten und bekommt folgendes:
b = log c.
M
 Mach, Ernst:
Mach, Ernst:
Deutscher Physiker und Philosoph, * 18. 2. 1838 in Turas, Mähren, † 19. 2. 1916 in Haar bei München.
Er lehrte in Graz, Prag und Wien. Nach Mach gab es nur Empfindungen, denn Gesetzmäßigkeiten waren für ihn funktional. Er war Positivist und beeinflusste das naturwissenschaftliche Denken der Folgezeit.
Auf den Gebieten der Akustik und Optik (Mach'scher Kegel, Machzahl) arbeitete er auch. Seine Hauptwerke: "Die Analyse der Empfindungen und des Verhältnisses des Physischen zum Psychischen” 1900; "Erkenntnis und Irrtum. Skizzen zur Psychologie der Forschung” 1905.
Mariotte, Edmé:
(1620-1684) Französischer Physiker. * um 1620 vermutlich in Dijon, † 12. 5. 1684 in Paris.
Er war katholischer Geistlicher und arbeitete auf dem Gebiet der Hydrostatik und Hydraulik. Er untersuchte u. a. den
osmotischen Druck bei Pflanzen und entdeckte den blinden Fleck im Auge.
Unabhängig von Robert Boyle fand er heraus, das sich Druck und Volumen eines
Gases indirekt proportional verhalten, daher auch der Name Boyle-Mariotte'sche Gesetz.
Maxwell, James Clerk:


Schottischer Physiker, * 13. 6. 1831 in Middlebie bei Edinburgh, † 5. 11. 1879 in Cambridge.
Von 1856-1865 war er Professor in Aberdeen und London, danach Privatlehrer und ab 1871 Professor in Cambridge.
Maxwell war der bedeutendste theoretische Physiker des 19. Jahrhunderts. Er stellte 1873 die Maxwell'schen Gleichungen
(Maxwell'sche Theorie) auf und gab damit die theoretischen Grundlagen für die von Faraday gefundenen Zusammenhänge zwischen Strom und Magnetfeld.
Nach Maxwell (1865) besteht das Licht aus kurzen elektromagnetischen Wellen.
1886 wies H. Hertz die von Maxwell vorausgesagten Wellen nach.
Außerdem baute Maxwell die kinetische Gastheorie (Maxwellverteilung, Geschwindigkeitsverteilung) aus und leistete
Bedeutendes auf dem Gebiet der Thermodynamik.
 Mayer, Julius Robert von:
Mayer, Julius Robert von:
Deutscher Naturforscher und Arzt, * 25. 11. 1814 in Heilbronn, † 20. 3. 1878 auch in Heilbronn
Er stellte 1842 das Gesetz von der Erhaltung der Energie auf und erkannte dessen Richtigkeit auch im Bereich des Organischen.
Außerdem bestimmte er das mechanische Wärmeäquivalent durch seine Experimente, bekam dafür aber erst spät Anerkennung.
mol:
Abkürzung für Molekül, Einheit der Stoffmenge.
Die Conférence Générale des Poids et Mesures (CGPM), die Internationale Organisation für Standardisierung
(ISO), die Internationale Union für reine und angewandte Chemie (IUPAC)
und das Deutsche Institut für Normung (DIN) haben sich auf diese Einheit geeinigt.
In der Stoffmenge
n = 1 mol sind 6,022 * 1023 Teilchen (z.B. Atome, Moleküle) enthalten.
Dieser Zahlenwert wurde festgelegt, indem man die Anzahl der Teilchen von 0,012g des Kohlenstoffs 12C als Basisgröße für ein mol nahm.
Molekül:
[französisch, "kleine Masse”]
Das kleinste Teilchen einer chemischen Verbindung aus zwei oder mehr Atomen
.
Die einzelnen Atome werden im Molekül durch verschiede chemische Bindungen zusammengehalten. Der Durchmesser der kleinsten Moleküle beträgt etwa 10-8 cm (Wasserstoffmoleküle).
N
Nernst, Walther:
Deutscher Physiker und Chemiker, *25. 6. 1865 in Briesen (Westpreussen), † 18. 1. 1941 in Gut Ober-Zibelle (bei Muskau, Niederlausitz).
Er lehrte in Göttingen und in Berlin (ab 1905). Von 1922 bis 1924 war er der Präsident der physikalisch-technischen Reichsanstalt.
Er stellte den 3. Hauptsatz auf, das sog. Nernst´sche Wärmetheorem, und verfasste bedeutende
Arbeiten über die Elektrolyse und chemische Gleichgewichte. 1897 hat er die sog. Nernstlampe, die sehr hell leuchtet, gebaut, bei der
ein Erdmetalloxidstab zum Glühen gebracht wird.
1920 erhielt er den Nobelpreis für Chemie.
O
Ostwald, Friedrich Wilhelm:
Deutscher Chemiker und Philosoph, * 2. 9. 1853 in Riga, † 4. 4. 1932 in Großbothen bei Leipzig.
Er führte Untersuchungen über Reaktionsgeschwindigkeiten, Katalyse, chemische Gleichgewichte, elektrochemische und thermodynamische Sachverhalte durch und
erfand das Verfahren zur Herstellung von Salpetersäure. Außerdem machte er sich um die Farbenlehre verdient. 1909 erhielt er den Nobelpreis für Chemie.
In der Philosophie war er Gegner des älteren naturwissenschaftlichen Materialismus, dem er seine Energetik gegenüberstellte, obwohl er Naturalist war.
Der Begriff der Energie beherrschte für ihn die Lebens-, die Kultur- und die Wertwissenschaften.
Ostwald formulierte den Satz: "Vergeude keine Energie, veredle sie!”
In seinem Denken berührte sich Ostwald mit A. Comte, E. Mach und E. Haeckel, deren "Monistenbund” er ab 1911 leitete.
P
Perpetuum mobile:
[lateinisch, "dauernd laufend”]
Eine Maschine, die fortwährend Arbeit aus nichts produziert.
Es werden verschiedene Arten unterschieden:
- 1. Art: Eine Maschine, die ohne Energiezufuhr von außen fortwährend Arbeit leistet. Dies widerspricht
allerdings dem Energieerhaltungssatz (siehe 1. Hauptsatz).
- 2. Art: Eine Maschine, die ständig Arbeit leistet und die benötigte Energie
der Wärme der Umgebung
entzieht. Dies widerspricht dem 2. Hauptsatz der Thermodynamik und ist deswegen
nicht möglich.
Der Bau eines Perpetuum mobile wird schon seit langer Zeit (ungefähr seit dem 13. Jahrhundert) von zahlreichen
Erfindern immer wieder versucht. Jedoch lehnt die Pariser Akademie der Wissenschaften seit 1775 alle Vorschläge und
Konstruktionspläne für Perpetuum mobiles ab.
Plank, Max Karl Ernst Ludwig:
Deutscher Physiker, * 25. 4. 1858 in Kiel, † 4. 10. 1947 in Göttingen.
Ab dem Jahre 1885 war er Professor in Kiel und von 1889 bis 1926 in Berlin für theoretische Physik. Von 1930 bis 1937
war er der Präsident der Kaiser-Wilhelm-Gesellschaft (die ihm zu Ehren in Max-Plank-Gesellschaft umbenannt wurde) und seit 1894 war er Mitglied der Preußischen Akademie der
Wissenschaften.
Sein Hauptforschungsgebiet war die Thermodynamik. 1900 stellte er Grundlagen zur Quantentheorie auf, die ihm 1918 den Nobelpreis
einbrachten.
Nach ihm benannt wurde das Plank´sche Strahlungsgesetz und das Plank´sche Wirkungsquantum (mit der Plank´schen Konstante).
Er schrieb unter anderem:
"Einführung in die theoretische Physik" (5 Bände von 1916-1930)
"Wege zur physikalischen Erkenntnis", 1948
 Poincaré, Henri:
Poincaré, Henri:
Französischer Mathematiker und Astronom, * 29. 4. 1854 in Nancy, † 17. 7. 1912 in Paris.
Er war Professor in Paris und arbeitete in den Bereichen der Funktionentheorie, der Algebra, der Differentialgleichungen und der theoretischen Physik (Elektrodynamik, Lichttheorie).
Außerdem veröffentlichte er auch philosophische Arbeiten.
Seine astronomischen Werke bilden den Abschluß und den Höhepunkt der klassischen Epoche der theoretischen
Astronomie.
proportional:
[lateinisch]
In gleichem Verhältnis stehend, eine Proportion (Ebenmaß, Gleichmaß, Größenverhältnis) ausdrückend
Q
quantitativ:
Hinsichtlich der Menge, Größe, Anzahl, dem Umfang nach.
Eine quantitative Analyse ist eine Gewichtsanalyse bzw. eine Feststellung der Mengen von Bestandteilen eines Stoffgemisches.
R
Reaumur:
Zeichen: R
Veraltete Gradeinteilung des Thermometers (nach dem französichem Physiker René-Antoine Ferchault de Réaumur).
Bei dieser Skala ist der Temperaturabstand zwischen Schmelz- und Siedepunkt des Wassers (0°C und 100°C) in 80 Teile eingeteilt.
reversibel:
[lateinisch]
umkehrbar (meist benutzt bei physikalischen oder chemischen Vorgängen); Gegensatz: irreversibel.
S
statistisch:
Durch Zahlen belegt.
Statistische Physik: Behandlung einer sehr großen Zahl gleicher Objekte (z.B. der Moleküle in einem
Gas) mit Mitteln der Wahrscheinlichkeitsrechnung und der Statistik.
Stoffmenge n:
Die Stoffmenge ist ein Maß für die Anzahl von Teilchen (z.B. Atome,
Molekülen, Ionen) in einer bestimmten Portion, unabhängig vom physikalischen Aggregatszustand (fest, flüssig, gasförmig).
Die Einheit der Stoffmenge ist das Mol.
Nach dem internationalen Einheitensystem (SI) ist in einem Mol die gleiche Menge an Teilchen (Atomen, Molekülen, Ionen) enthalten, wie in 0,012 kg des Kohlenstoffs 12C. Das sind 6,022 * 1023 Teilchen (sog. Avogadro-Konstante).
T
Temperatur:
[lateinisch], Temperatur ist eine Größe, die den Wärmezustand eines physikalischen Systems, z.B. eines Körpers, einer Flüssigkeit oder eines Gases kennzeichnet.
Die Temperatur ist ein Maß für die Energie des Systems.
Sie ist zu unterscheiden von der Wärme, einer Energieform. Gemessen wird sie mit Thermometern. Der absolute Nullpunkt (0 K [Kelvin]) ist die kleinste Temperatur;
man kann ihn nur näherungsweise erreichen (siehe 3.Haupsatz).
In der Physik ist die Kelvinskala gebräuchlich, im täglichen Leben dagegen hat sich die Celsiustemperaturskala durchgesetzt. In den USA werden Temperaturen manchmal noch in Fahrenheit angegeben.
Temperaturskalen:
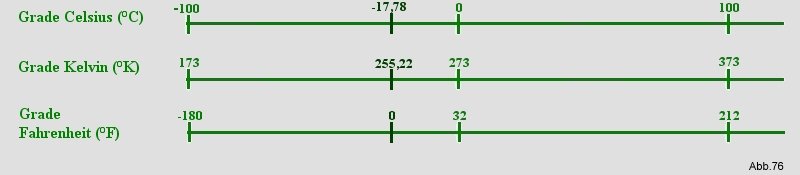
Thermisch:
[griechisch]: die Wärme betreffend
z.B.thermisches Verhalten von Gasen:
Verhalten gegen Temperaturveränderungen
- thermische Reaktion eines Stoffgemischs: eine Reaktion bei der Wärme verbraucht oder erzeugt wird.
Thermisch kennzeichnet auch die Energie, die Teilchen ( Atome bzw. Moleküle)
aufgrund der Wärmebewegung haben.
Thermometer:
[griechisch]
Ein Messgerät, das die Temperatur anzeigt. Sein Inhalt muß leicht feststellbare und reproduzierbare Zustände bei unterschiedlichen Temperaturen durchlaufen, wie z.B. Siede- und Gefrierpunkt von
reinem Wasser unter Normalbedingungen. Es muss klein sein, damit es kaum Wärme entziehen kann,
weil die Messung sonst verfälscht werden würde.
Am häufigsten sind die sog. Ausdehnungsthermometer, die auf der Ausdehnung von Flüssigkeiten (z.B. Alkohol),
Gasen (z.B. Luft; auch Gasthermometer genannt) oder Metallen (z.B. Quecksilber) beruhen.
Die Temperatur wird mittels einer Skala gemessen (z.B. Celsiusskala),
die in Grade eingeteilt ist.
 Sir (ab 1784) Thompson, Benjamin, Graf von Rumford (erst ab 1791):
Sir (ab 1784) Thompson, Benjamin, Graf von Rumford (erst ab 1791):
US-amerikanischer Physiker, * 26. 3. 1753 in North Woburn, Massachusetts, † 21. 8. 1814 in Auteuil bei Paris.
Seine Arbeit befaßte sich hauptsächlich mit Wärme (1778: Bestimmung des mechanischen Wärmeäquivalentes).
Er war auch in englischen Diensten und ab 1784 sogar bayerischer Minister. Ihm ist u.a. der Englische Garten in München zu verdanken. Außerdem setzte er sich für Arbeitshäuser und die Volksernährung ein,
weswegen er auch die Kartoffel in Bayern einführte. 1798 kehrte er nach England zurück und gründete 1799 dort die "Royal Institution of Great Britain".
U
V
Volumen:
Abkürzung: V
Rauminhalt
W
Waals, Johannes Diderik van der:
Niederländischer Physiker, * 23. 11. 1837 in Leiden, † 8. 3. 1923 in Amsterdam.
Er war Professor in Amsterdam und entwickelte die van-der-Waals'sche Zustandsgleichung, die das Verhalten der realen Gase beschreibt.
Die Abweichung der realen Gase von den idealen liegt u.a. an der gegenseitigen Anziehung der Gasmoleküle durch die sog. van-der-Waals'schen Kräfte. 1910 erhielt er den Nobelpreis für Physik.
Wärme:
Eine Energieform. Abkürzung Q.
Bis in das 19. Jahrhundert wurde die Wärme als ein gewichtsloser Stoff angesehen.
Erst J. R. von Mayer (1842), H. von Helmholtz, Graf Rumford und J. P. Joule erkannten, daß mechanische Energie in Wärme und Wärme in mechanische Energie umgewandelt werden können.
Heute hat man die Ansicht, daß Wärme die Bewegungsenergie von atomaren Teilchen ist.
Sie besteht z.B. bei Kristallen aus den Schwingungen der Atome gegeneinander,
in Gasen und Flüssigkeiten aus der ungeordneten Bewegung von den Teilchen, aus der Rotation der Moleküle und aus der Schwingung ihrer Atome.
Es wurde lang nicht zwischen der extensiven Größe Wärme und der intensiven Größe Temperatur unterschieden.
Man verwendete für beide den Namen Calor. Joseph Blake betonte jedoch in seinem Werk "lectures on the elements of chemistry" den Unterschied.
Er bewieß, daß das chemische Gleichgewicht eine Gleicheit der Temperatur verlangt, daß aber
in den unterschiedlichen Körpern in einem System nicht die gleiche Wärmemenge enthalten sein muss.
Die Wärmemenge wird in Joule [J] gemessen, die früher verwendete Einheit Kalorie (1 cal = 4,184 J) ist seit dem 1. 1. 1978 nicht mehr gültig.
Wärmelehre:
Teilgebiet der Physik, das
sich mit den Erscheinungen der Wärme befaßt. Je nach
Betrachtungsweise, wird sie eingeteilt in phänomenologische Wärmelehre
(Beschreibung der makroskopischen Erscheinungen und ihren
Gesetzmäßigkeiten) und statistische (wahrscheinlichkeitstheoretische)
Wärmelehre.
Für die Thermodynamik sind die Hauptsätze der
Wärmelehre maßgeblich:
1.Hauptsatz:
Energieerhaltungssatz (Wärme kann in andere Energieformen übergeführt oder aus diesen erzeugt
werden, sie kann aber nicht aus nichts entstehen).
2.Hauptsatz: Entropie.
3.Hauptsatz: Nernst'sches
Wärmetheorem.
Watt, James:
Schottischer Erfinder, * 19. 1. 1736 in Greenock, † 19.
8. 1819 in Heathfield bei Birmingham.
Er war ein Mechaniker in Glasgow und
gründete 1774 zusammen mit M. Boulton eine Maschinenfabrik. Er erfand u.a.
die erste Dampfmaschine, die Kopierpresse und den Dampfkondensator.
Wirkungsgrad:
Zeichen: h
Ausbeute, Nutzeffekt
Der Wirkungsgrad ist das Verhältnis der nutzbringend gewonnenen Energie zur aufgewendeten, z.B.: der Wirkungsgrad einer Maschine
X
Y
Z
 Zermelo, Ernst:
Zermelo, Ernst:
Deutscher Mathematiker, * 27. 7. 1871 in Berlin, † 21. 5. 1953 in Freiburg im Breisgau.
1908 stellte er den ersten grundlegenden Satz für die Carnot´sche Mengenlehre auf. Er arbeitete auf dem Gebiet der Variationsrechnung, Mengenlehre und statistischer Mechanik.
|