Herleitung: Bei den
beiden Gleichungen von
Gay-Lussac und
Boyle-Mariotte war immer eine Variable, im ersten
Fall der
Druck, im zweiten die
Temperatur gleichbleibend (=konstant). Um jedoch
uneingeschränkt rechnen zu können, braucht man eine Gleichung, die
den Zusammenhang zwischen allen drei Größen (Druck, Temperatur und
Volumen) beschreibt. Dazu muss man die Gesetze von
Gay-Lussac und Boyle-Mariotte zusammenfassen. Man geht von einem
System aus, das eine Temperatur T
1, einen Druck p
1 und ein Volumen V
1 hat:
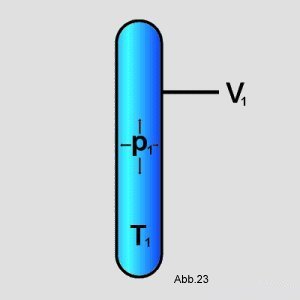
Der Druck wird verändert auf
p
2 und die Temperatur
auf T
2. Die Frage ist:
Wie sieht dann das Volumen V
2 aus?
Im ersten Schritt wird der Druck von
p
1 auf p
2 geändert. Die Temperatur
wird dabei gleich gehalten. Folglich läßt sich das Gesetz von
Boyle-Mariotte anwenden. Man benützt dazu
Formel (10) und löst diese nach V
x auf (Im graphischen Beispiel wird der Druck
erhöht):
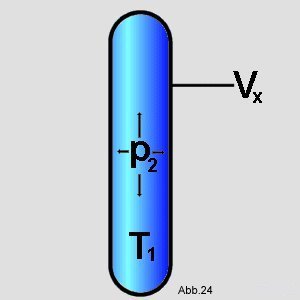
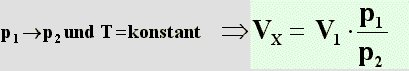 | (11) |
Danach hält man den neuen Druck p
2 konstant und verändert
nur die Temperatur von T
1 auf
T
2. Dieser Vorgang läßt sich durch das Gesetz von
Gay-Lussac berechnen. Man benützt dazu Formel (7) (Im graphischen Beispiel wird die
Temperatur
erhöht):
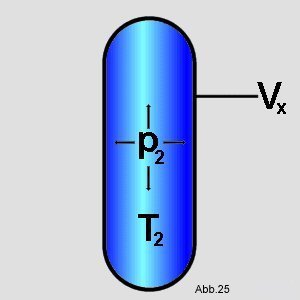
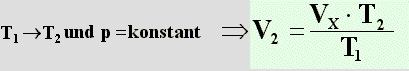
| (12) |
In die zweite Gleichung setzt man V
x aus der ersten Gleichung
ein, und erhält folgendes:
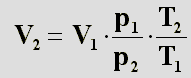
| (13) |
Umgestellt ergibt sich:
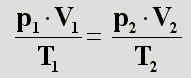
| (14) |
| Daraus folgt weiterhin, daß | 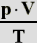
| konstant ist.
|
Man weiß nun, daß das Produkt aus Volumen und Druck auf die Temperatur bezogen einen konstanten Wert hat. Um diesen
berechnen zu können, benötigt man die drei zusammenhängenden Werte an einem bestimmten Punkt. Als Bezugszustand kann
man den eines idealen Gases bei einem Druck von 1,013
bar und einer Temperatur
von 273,15 K (= 0°C) wählen. An diesem Punkt beträgt nach
Avogadro das Volumen
eines
Mols
eines
idealen Gases 22,414 l (= 22,414 dm
3).
Deswegen muss man noch die
Stoffmenge n einbeziehen, damit man die molaren Verhältnisse erhält. Diese Werte werden
mit der 0 als Index versehen, da sie sich auf den Punkt bei 0°C beziehen.
Man kann sie nun in die Gleichung einsetzen und erhält:
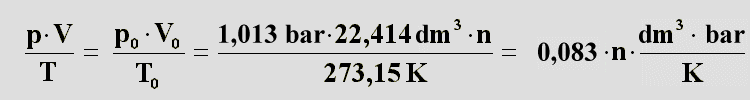
| (15) |
Die grün unterlegte Zahl und die Einheiten dahinter sind immer gleich, egal welchen Punkt man betrachtet hat. Sie
sind die Konstante die R genannt wird und den Namen "Allgemeine Gaskonstante" trägt. Nun kann man das
ideale
Gasgesetz formulieren:
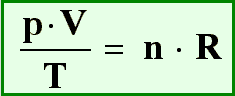
| (16) |
Beispiel:
Man läßt 2
mol Sauerstof O
2 in ein umgekehrtes, mit
Wasser gefülltes Gefäß blubbern:
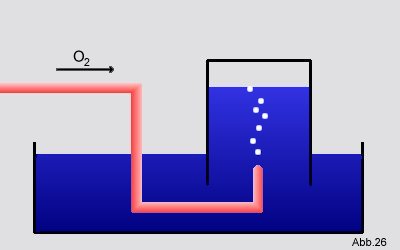 Gegeben:
Gegeben: Die Außentemperatur beträgt 25°C und der Luftdruck 1,013
bar.
Frage: Wie groß ist das Volumen, das der Sauerstoff einnehmen wird?
Lösung: Hier kann man das ideale Gasgesetz anwenden. Es lautet wie folgt:
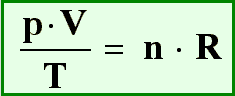
Die Stoffmenge n ist 2 mol, die Temperatur beträgt 298K (25°C + 273) und der Druck beträgt 1,013 bar
(normaler Luftdruck). Außerdem benötigt man noch den Wert der allgemeinen Gaskonstante R. Er beträgt: 0,083
(cm
3 * bar) / K (siehe Formel (15)). Diese Werte setzt man nun in
die Formel ein:
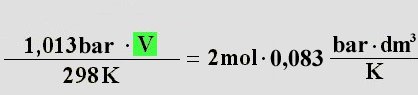
Diese löst man nun nach dem Volumen V auf:
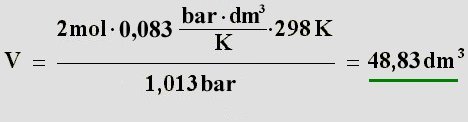 Antwort:
Antwort: Es ergibt sich ein Sauerstoffvolumen von 48,83 dm
3 bzw. Liter
(1 dm
3 = 1 Liter).