Es gibt viele Wissenschaftler, die versucht haben, eine Formel zu finden, die sich auch auf alle realen Gase
anwenden läßt. Sie haben dabei oft komplizierte Formeln aufgestellt. Hier wird aber nur die von
Van-der-Waals gezeigt.
Volumenberichtigung: Wie bei den
realen Gasen gesehen, haben die
Moleküle ein
Eigenvolumen, das bei den
idealen Gasen nicht berücksichtigt wird. Van-der-Waals
bezeichnete dies mit dem Buchstaben
b. Das bezieht sich aber nur auf ein
mol.
Deswegen muss man b noch mit der
Stoffmenge n multiplizieren, um das gesamte
Volumen zu erhalten, das die Teilchen
einnehmen. Diesen Wert muss man nun von dem gemessenen Volumen abziehen (siehe
reale Gase):
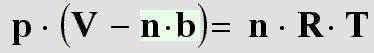
| (19) |
Druckberichtigung: Da bei einem
idealen Gas die gegenseitige Anziehung weggelassen
wurde, die die Teilchen aufeinander ausüben (siehe:
reale Gase), muß man den gemessenen
Druck auch noch berichtigen.
Jedes Teilchen im Gas übt eine Anziehung aus, deswegen ist es wichtig, zu wissen, wieviele Teilchen in dem Gas
sind. Wir nehmen an, daß das Gas N Teilchen enthält. Die Dichte des Gases ist N/V. Umso größer die Dichte des
Gases ist, desto mehr Teilchen stoßen an die Wand. Daraus folgt, daß die Dichte proportional zur Anzahl der
stoßenden Teilchen ist. Ebenso ist sie proportional zu den sich zurückziehenden Teilchen. Da es bei größerer
Stoffmenge mehr Teilchen sind, ist die Teilchenzahl N der Stoffmenge n proportional. Deswegen
kann man N durch n ersetzen. Da es immer zwei Teilchen sind, deren Kräfte aufeinander wirken, muß man
quadrieren, und erhält folgendes: (n/V)
2.
Van-der-Waals nannte den Größenverhältnisfaktor
a und erhielt folgende
Formel für den Druck, der dazu addiert werden muss:
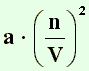
| (20) |
Die gesamte korrigierte Formel sieht nun so aus:
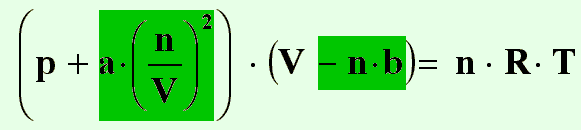
| (21) |
Die Werte der Konstanten a und b sind für die meisten Gase bereits bestimmt worden. Normalerweise sind die b-Werte
von Gasen mit größeren
Molekülen größer als Werte der Gase mit kleineren Molekülen.
Über die a-Werte kann man sagen, daß Moleküle mit größerer Oberfläche sich gegenseitig stärker anziehen, und
deswegen auch größere Werte liefern.
Die Van-der-Waals´sche Gleichung gilt immer noch nicht für alle Druck- und Temperaturbereiche, jedoch ist sie
eine bessere Annäherung an das Verhalten von realen Gasen als die
ideale Gasgleichung.
Bei kleinen Drucken und
Zimmertemperatur jedoch kann man sie sehr gut anwenden. Unter diesen Voraussetzungen ist sogar die ideale
Gasgleichung relativ genau gültig, sodaß in der Praxis oftmals doch nur mit letzterer gerechnet wird.