Amyloidose
Krankhaften Eiweißablagerungen auf der Spur
Die systemische Amyloidose ist eine Krankheit mit vielen Gesichtern und kann binnen weniger Monate zum Tod führen. In einer neuen DFG-Forschungsgruppe wollen Wissenschaftler um Professor Marcus Fändrich aufklären, welche proteinbiochemischen Faktoren zum Ausbruch und zu den so unterschiedlichen Ausprägungen der seltenen Erkrankung.

Bei der systemischen Amyloidose sammeln sich körpereigene, krankhaft veränderte Eiweiße im Gewebe oder in Organen an - allen voran in Herz und Niere. Diese Ablagerungen führen zu Fehlfunktionen bis hin zum Organversagen. Was die Menge der Amyloidablagerungen und den Krankheitsverlauf angeht, gibt es jedoch große Unterschiede: Jeder der jährlich rund 250 im bundesweiten Amyloidose-Zentrum des Universitätsklinikums Heidelberg diagnostizierten Patienten zeigt ein individuelles Krankheitsbild. Die häufigste Form, die Leichtketten- oder AL-Amyloidose, verläuft oft sehr aggressiv: Schon nach kurzer Krankheitsdauer kann eine Organtransplantation nötig werden. Mit Fördergeldern von über 2,1 Millionen Euro wollen Forschende der Universitäten Ulm, Erlangen-Nürnberg, Heidelberg, Kiel sowie der TU München die Ursache und die so unterschiedlichen Verläufe der AL-Amyloidose ergründen.
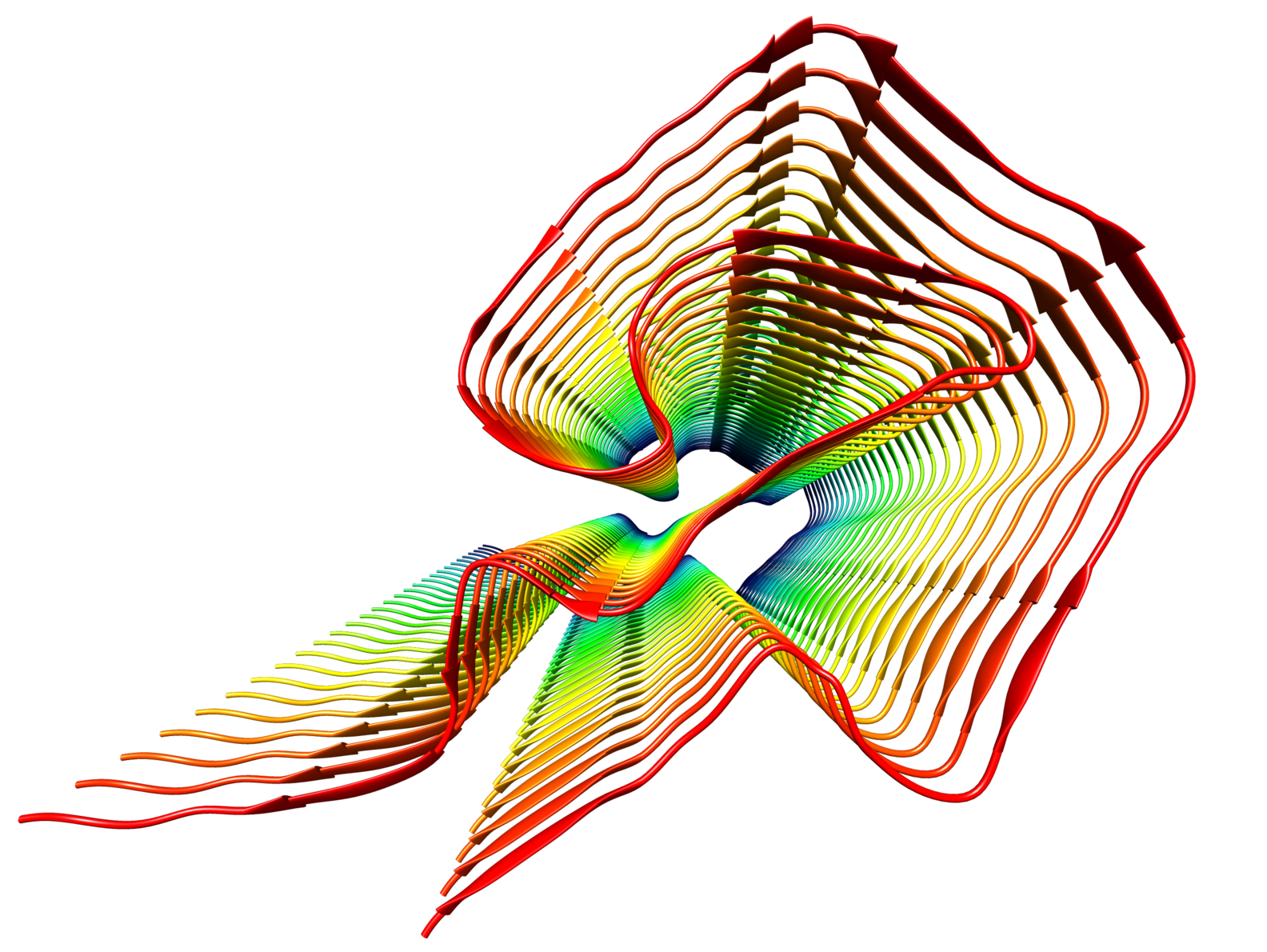
Die AL-Amyloidose ist zwar relativ selten, gilt jedoch als Archetyp einer patientenspezifirschen Protein-Faltungskrankheit
Auslöser der AL-Amyloidose ist wohl eine Fehlfaltung der sogenannten Antikörper-Leichtketten, die zu den charakteristischen Ablagerungen im Gewebe führt. Dieser krankhafte Prozess wird zum Beispiel bei Krebspatienten mit einem Multiplen Myelom beobachtet. Aber warum entwickeln lediglich fünf Prozent aller Patienten mit einer solchen Vorerkrankung eine AL-Amyloidose? Und wie kommt es zu so unterschiedlichen Krankheitsbildern? Diesen Leitfragen will die neue Forschungsgruppe 2969 "Mechanismen der Fehlfaltung von Antikörper-Leichtketten in der systemischen AL-Amyloidose" mit einem breiten biochemischen Methodenspektrum nachgehen. Dazu kommen innovative bildgebende Verfahren wie das sogenannte MALDI-Imaging oder die mit einem Nobelpreis geadelte Kryo-Elektronenmikroskopie. Denn bisher ist unbekannt, warum die Erkrankung in einem Fall primär das Herz, im anderen Fall die Niere betrifft. Auch Mechanismen, die der Fehlfaltung der Leichtketten zugrunde liegen, und das Zusammenwirken der Ablagerungen mit Geweben sind weitgehend unverstanden. "Die AL-Amyloidose ist zwar relativ selten, gilt jedoch als Archetyp einer patientenspezifischen Protein-Fehlfaltungskrankheit. Ein tieferes Verständnis der proteinbiochemischen Grundlagen ist die Voraussetzung für die Entwicklung neuer Behandlungsansätze", erklärt Professor Marcus Fändrich, Leiter des Instituts für Proteinbiochemie und Sprecher der DFG-Forschungsgruppe.
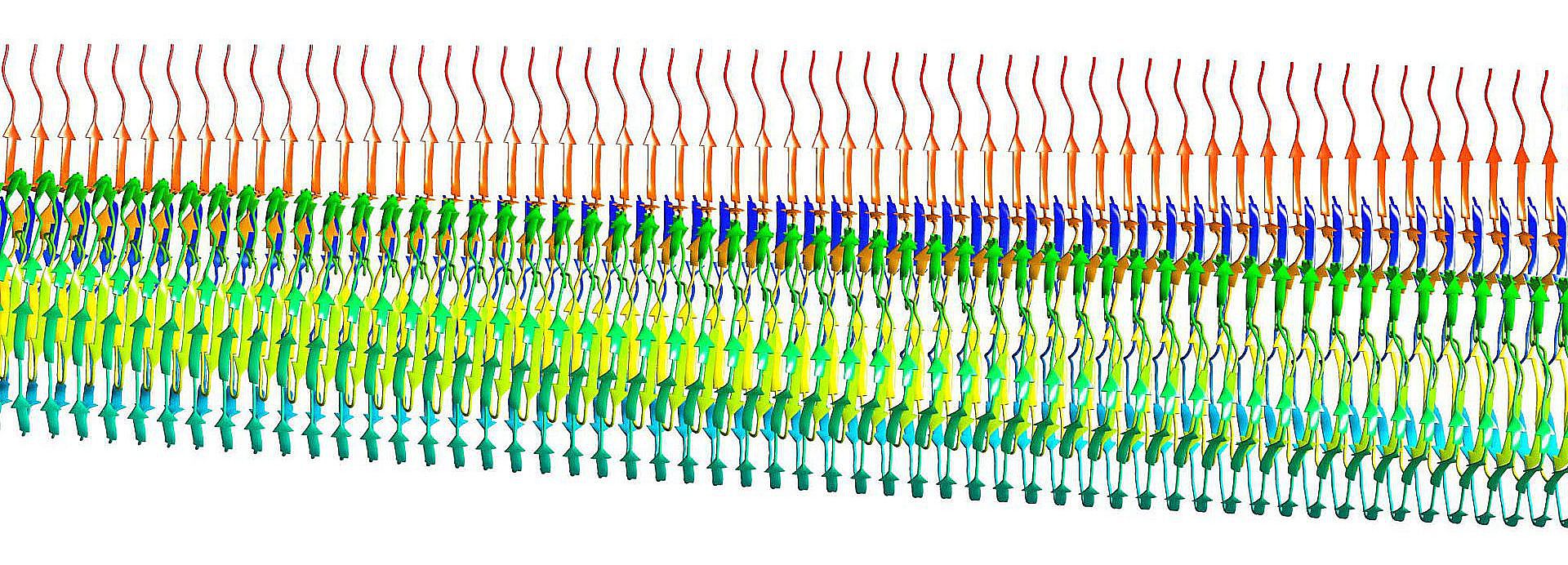
Die Wissenschaftlerinnen und Wissenschaftler aus Medizin und Lebenswissenschaften nehmen an, dass die unterschiedlichen Krankheitsbilder der AL-Amyloidose durch die hochgradige Variabilität natürlicher Leichtketten und somit durch unterschiedliche Proteineigenschaften bedingt sind. Um diese Hypothese zu prüfen, analysieren die Forschenden unter anderem Blut, Nieren- und Herzgewebe sowie Knochenmark und Fett von Patienten: So sollen Charakteristika der extrahierten Amyloidablagerungen mit Krankheitsausprägung und Organbefall korreliert werden.
Eine DFG-Forschungsgruppe ist ein Arbeitsbündnis hervorragender Wissenschaftlerinnen und Wissenschaftler zu einem aktuellen Forschungsthema. Die Zusammenarbeit ist zunächst auf drei Jahre angelegt, dann erfolgt eine neue Begutachtung und im Erfolgsfall eine zweite Förderperiode. Neben exzellenter Wissenschaft hat die Forschungsgruppe beispielsweise auch die Nachwuchsförderung zum Ziel.
Von Seiten der Universität Ulm bringt das Institut für Proteinbiochemie seine Expertise in die Forschungsgruppe ein: Mittels Kryo-Elektronenmikroskopie wird die Arbeitsgruppe Fändrich die Struktur von Amyloidfibrillen aus dem Herzgewebe betroffener Patienten untersuchen, während Dr. Christian Haupt in enger Zusammenarbeit mit Ärzten des Heidelberger Amyloidose-Zentrums die Variabilität der krankhaften Amyloidfibrillen bei Patienten mit hauptsächlichem Herz- oder Nierenbefall vergleicht. Ziel sind mögliche Rückschlüsse auf die Entstehung der verschiedenen Krankheitsbilder. "Ein weiteres Anliegen der weltweit in dieser Ausrichtung einzigartigen Forschungsgruppe ist es, die relativ seltene Erkrankung einer breiteren Öffentlichkeit bekannt zu machen", so Fändrich. Die künftigen Ergebnisse der Gruppe dienen nämlich nicht nur der Grundlagenforschung: Langfristig könnten sie die Frühdiagnose und somit die Versorgung von Amyloidose-Patienten verbessern.
Text: Annika Bingmann
Abbildungen: Institut für Proteinbiochemie
Video: Daniela Stang
