[griechisch: en „darin, innerhalb” + thalpein „warm machen” bzw. thalpos „Wärme“]
Die Enthalpie H ist eine thermodynamische
Zustandsgröße. Sie ist eine Bezeichnung
für die abgegebene bzw. aufgenommene
Wärmemenge einer Reaktion. Sie wird in kJ (Kilojoule) gemessen. Man kann nicht die
Enthalpie eines Zustands messen, sondern nur
immer die Differenz zwischen zwei Zuständen. Geht ein Zustand durch Reaktion in einen anderen über, so kann man die
abgegebene bzw. aufgenommene
Wärmemenge messen, sie wird
DH
genannt:

Reaktionen, bei denen Wärme abgegeben wird nennt man
exotherm. Die Zahlenwerte werden
mit einem negativen Vorzeichen versehen.
Solche Reaktionen, die Wärme benötigen werden
endotherm
genannt. Ihre Zahlenwerte werden mit einem positiven Vorzeichen versehen.
Ein Beispiel für eine
exotherme Reaktion ist die Knallgasreaktion zwischen Sauerstoff und Wasserstoff zu Wasser:

| (22) |
Dabei wird eine Enthalpie
DH von - 484 kJ/mol freigesetzt. Sie äußert sich unter
anderem in einem lauten Knall, der dieser Reaktion seinen Namen verlieh.
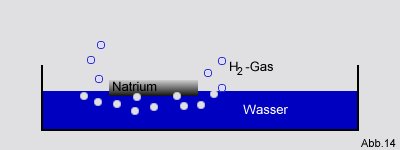
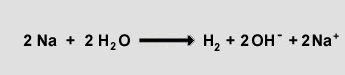
Auch die vorher schon angesprochene Reaktion von elementarem Natrium mit Wasser (siehe
Gasgesetz von Gay-Lussac) ist eine exotherme Reaktion:
| (23) |
Dabei wird Enthalpie frei, die man unter anderem in der schnellen Bewegung des Natriums über die Wasseroberfläche sehen
kann.
Endotherme Reaktionen dagegen benötigen Wärme um ablaufen zu können. Läßt man z.B. die beiden
Gase Stickstoff und
Sauerstoff miteinander zu Stickstoffmonoxid reagieren, benötigt man Wärmemenge, damit diese Reaktion ablaufen kann. In
der Natur reagieren diese beiden Gase (die ja beide in der Luft vorkommen) z.B. bei einem Blitzschlag miteinander, da
dieser die ausreichende Wärmemenge liefert:

| (24) |
Dabei wird eine Enthalpie
DH von + 180,6 kJ/mol benötigt.
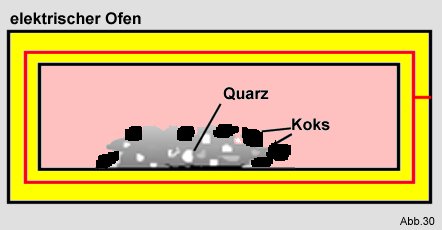
Ein weiteres Beispiel ist die Gewinnung von reinem Silicium. Dafür wird Quarz (SiO
2 = Siliciumoxid) mit Koks
(C = Kohlenstoff) in einem elektrischen Ofen umgesetzt:

| (25) |
Dabei wird eine Enthalpie
DH von + 690 kJ/mol benötigt.