Leitung
Prof. Cornelia Brunner
Tel: 0731 500 59714
Core Facility Managerin
Dr. Sybille Kempe
Tel: 0731 500 59715
Die ULMTeC Core Facility Immune Monitoring solider Tumoren bietet eine Serviceplattform der Medizinischen Fakultät der Universität und des Universitätsklinikums Ulm.
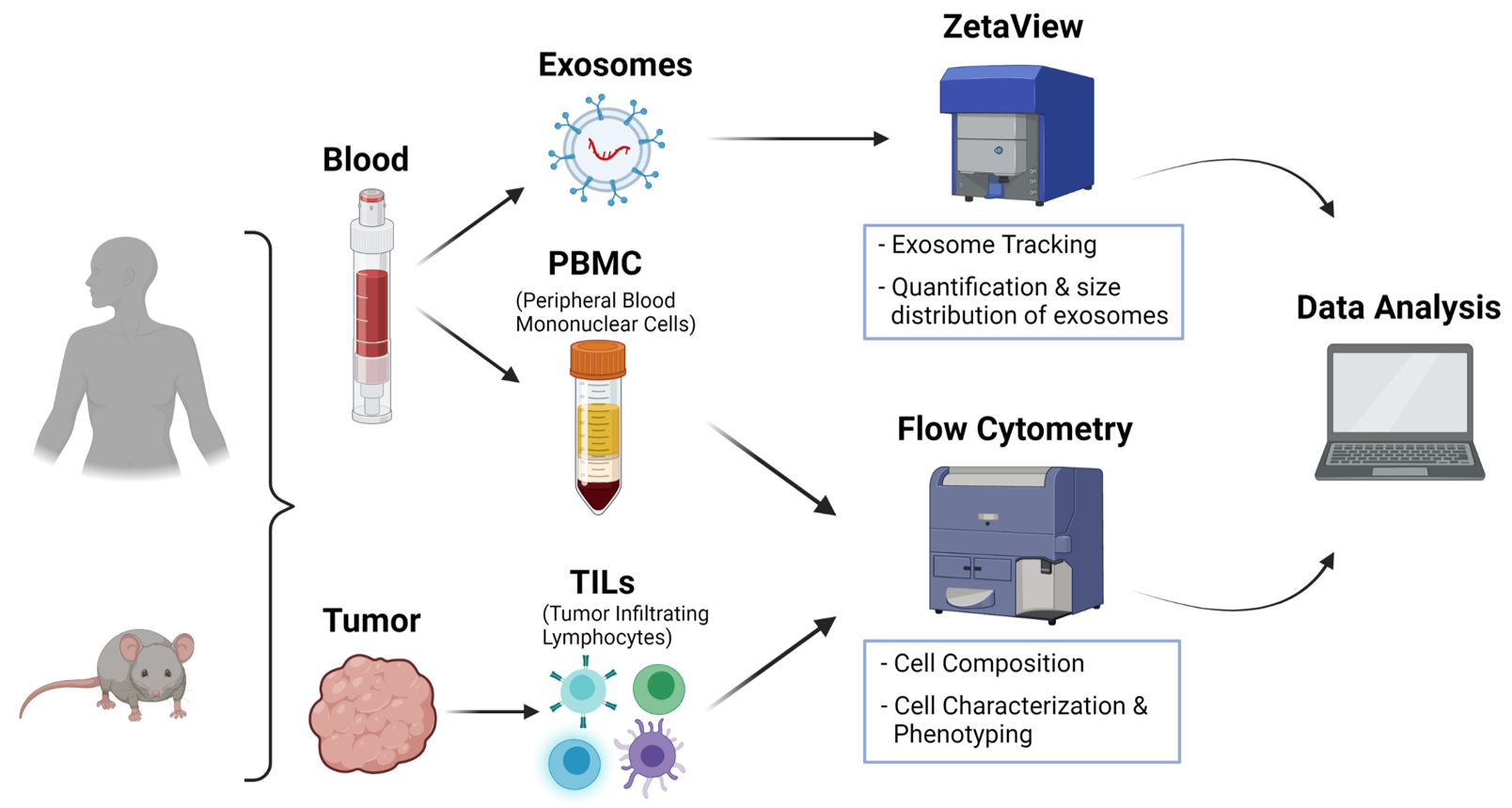
Unser Ziel ist es, einrichtungsübergreifend sowie externen Einrichtungen einen optimalen Full-Service im Bereich des Immune Monitorings solider Tumoren von Mensch und Maus anzubieten. Unser Full-Service erstreckt sich von der Probenverarbeitung, über die Färbung mittels standardisierten Panels zur Immunphänotypisierung bis hin zur Daten-Analyse und Interpretation. Sowohl humane (z.B. Tumor, PBMCs) als auch murine (z.B. Tumor, Blut, lymphatische Organe) Gewebeproben können aufgearbeitet und analysiert werden.
QuickLinks
Leistungen
Die angebotene Leistungen umfassen:
- Initiale Projektplanung
- Probenaufarbeitung (Mensch/Maus)
- Entwicklung und Etablierung von individuellen Färbeprotokollen
- Datenanalyse
Außerdem bieten wir Exosomen-Isolierung sowie Quantifizierung und Größenverteilung von Exosomen sowie Zellcharakterisierung und Phänotypisierung mittels standardisierter Färbepanels an. Darüber hinaus bieten wir unseren Service des Immune Monitorings immunologisch relevanter Organe für alle Forschungsgebiete (z. B. flüssige Tumoren, Trauma, Alterung, neurodegenerative Erkrankungen) an.
Ausstattung
Spektrales Durchflusszytometer Aurora von Cytek
Die Technologie der Spektral-Durchflusszytometrie und des spektralen Unmixing ermöglicht eine höhere Variabilität bei der Kombination von Farbstoffen, ein flexibleres Panel-Design sowie ein einfacheres Setup ohne Filterwechsel.
Das spektrale Durchflusszytometer Cytek® Aurora bietet:
- 4 Laser (blau, rot, violett, UV) und 57 Detektionskanäle (54 Fluoreszenzkanäle, FSC, blue laser SSC, violet laser SSC) ermöglichen die Erfassung des kompletten Emissionsspektrums
- Messung einzelner Tubes sowie im 40-Tube-Rack oder in verschiedenen 96-Well-Platten Formaten möglich
- hohe Durchsatzleistung: high-throughput-mode: 100 µl/min, 35.000 events pro Sekunde und throughput 96-Well-Platten: 27 Minuten im Hochdurchsatzmodus von 7 µl/well
- ''small particle detector": Partikel mit einer Größe von nahezu 100 nm können analysiert werden
- Autofluoreszenzextraktion verbessert die Auflösung
- Ca2+ Messungen möglich
- Volumenmessung während der Probenaufnahme ermöglicht die Berechnung der Zellzahl pro µl
Particle Metrix ZetaView, Particle Tracking Analyzer
Des Weiteren bieten wir die Isolierung von Exosomen und deren Analyse mittels ZetaView an. Mit diesem System können Exosome individuell gemessen werden und Messungen in Videoformat gespeichert werden. Das Gerät besteht aus einer Zelleinheit, einem Laser (488 nm), einem Mikroskop und einer Videokamera.
- Nanoparticle Tracking Analysis (NTA) Instrument zur Verfolgung der Bewegung von einzelnen visualisierten Nanopartikeln in Suspension (Mikrovesikel und Exosomen)
- Echtzeit-Visualisierung der Brownschen Bewegung und der elektrophoretischen Mobilität, zur Messung der Größe und Konzentration im Streu- und Fluoreszenzmodus
- Schnelles Scannen zur Erfassung und Analyse von typischerweise 1000 Partikeln in etwa 1 Minute
- Konzentrationsspanne: 105 – 109 Partikel/ml
- Partikelgröße: 10nm - 2000nm (abhängig von Probe und Laserauswahl)