zur 1. Aufgabe:
zur 2. Aufgabe:
|
|
Tip:
| Es ändern sich drei Zustandsgrößen, nämlich
Druck, Volumen und Temperatur.
Man muß also das ideale Gasgesetz anwenden. Es wird Formel (13) benötigt.
Da außerhalb des Kühlschranks Standardbedingungen herrschen, ist der neue Druck 1,013 bar und die Temperatur 25°C (=298 K). Somit
sind zwei der drei neuen Größen bekannt und man kann das veränderte Volumen berechnen.
zurück zur Aufgabe Antwort
|
zur 3. Aufgabe:
|
| Tip:
|
Bei dieser Aufgabe ändert sich die Temperatur und das Volumen. Der Druck bleibt gleich. Deswegen kann man das
Gesetz von Gay-Lussac anwenden. Es wird Formel (7) benötigt.
zurück zur Aufgabe Antwort
|
|
2. zu Reaktionstreibende Kräfte
|
zur 1. Aufgabe:
zur 2. Aufgabe:
zur 3. Aufgabe:
|
|
Tip:
| Läuft eine Reaktion bei positiver oder negativer freier Enthalpie freiwillig ab (siehe freie Enthalpie)? Ist sie dann
endergonisch oder exergonisch?
Um eine Reaktion zu erzwingen, muß man sie mit einer zweiten koppeln. Muß die gesamte freie Enthalpie dann postitiv oder negativ sein?
zurück zur Aufgabe Antwort
|
|
|
|
 |
 |
 |
| Testfragen |
Worterklärungen |
Quellenverzeichnis |
|
Vorheriges Kapitel |
|
|
 |
 |
|
|
|
|
zur 1. Aufgabe:
Antwort:
|
| Zunächst muß man das Volumen des Ballons errechnen. Für die Formel des Volumens braucht man den Radius r, weswegen man noch den
Druchmesser d durch zwei teilen muß. Man erhält einen Radius von 2,5 cm. Diesen kann man nun in die Volumenformel einsetzen und das Volumen berechnen:
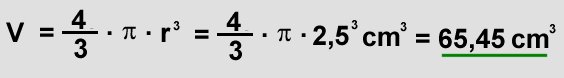
Nun kann man das neue Volumen mit der Formel von Boyle-Mariotte berechnen. Man verwendet Formel (10):

Daraus folgt für das neue Volumen des Ballons:

Den Durchmesser kann man wieder über die Formel für das Volumen berechnen, indem man zuerst einmal den Radius berechnet :
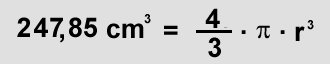

Der Durchmesser beträgt das Doppelte = 15,4 cm
zurück zur Aufgabe
|
zur 2. Aufgabe:
Antwort:
|
| Man braucht die Formel für ideale Gase, und zwar Formel (13), da sich alle drei Größen
(Volumen, Druck und Temperatur)
ändern. Außerhalb des Kühlschranks herrschen Standardbedingungen, das heißt die Temperatur liegt bei 298 K
(=25°C) und der Druck beträgt 1013 mbar. Die Temperatur um Kühlschrank beträgt 5°C, das entspricht 278 K. Diese Werte kann man nun einsetzen:
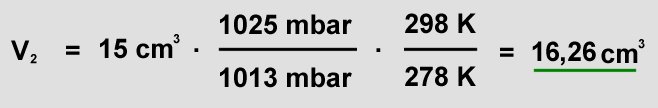
Das Volumen des Kohlendioxids beträgt außerhalb des Kühlschranks 16,26 cm3.
zurück zur Aufgabe
|
zur 3. Aufgabe:
Antwort:
|
| Man braucht hier das Gesetz von Gay-Lussac, da sich die Temperatur und das Volumen
ändern und der Druck gleichbleibt. Man baucht Formel (7).
Die Temperaturen müssen noch in Kelvin umgerechntet werden: 15°C = 288 K, 25°C = 298 K, 30°C = 303 K.
Nun kann man alle Werte einsetzen und die beiden Volumenänderungen berechnen:


Bei 25°C wächst das Volumen um 0,1 cm3 und bei 30°C um 0,3 cm3.
zurück zur Aufgabe
|
|
2. zu Reaktionstreibende Kräfte
|
| | | |