mIrisFP, ein neues fluoreszierendes Markerprotein für die Nanoskopie oder wie man wandernden Krebszellen auf die „molekularen Füße“ schauen kann
Wissenschaftler haben einen neuen Fluoreszenzfarbstoff entwickelt, um in lebenden Zellen Proteinwanderungen mit mikroskopischer Höchstauflösung verfolgen zu können.
Die klassischen Methoden der Lichtmikroskopie besitzen eine zu geringe Auflösung, um biologische Vorgänge auf der Ebene einzelner Moleküle in lebenden Zellen zu beobachten. Wie bereits Ernst Abbe (1873) in seinen Arbeiten zeigte, können zwei Punkte, die weniger als ~200 nm von einander entfernt sind, aufgrund der Wellennatur des Lichts nicht mehr getrennt sichtbar gemacht werden. Diese Auflösungsgrenze galt lange Zeit als nicht überwindbar. Da viele zelluläre Strukturen eine sehr viel geringere Größe als 200 nm haben, konnten sie bisher mit Hilfe des „konventionellen“ Lichtmikroskops nicht analysiert werden.
In den letzten Jahren wurden jedoch spezielle Mikroskopiemethoden entwickelt, die es erlauben, diese Barriere zu durchbrechen. Mikroskope, die mittels Fluoreszenzmarkierung, Bilder jenseits der 200 nm Auflösungsgrenze liefern, benötigen spezielle Fluoreszenzfarbstoffe, die sich gezielt mit Laserlicht an- und ausschalten lassen. Werden diese An-und Ausschaltvorgänge zeitlich so abgestimmt, dass zur gleichen Zeit immer nur Farbstoffmoleküle fluoreszieren, die weiter als 200 nm voneinander entfernt sind, können die einzelnen Farbstoffmoleküle als Lichtpunkte registriert werden. Mit Hilfe von Computer-Algorithmen wird dann die genaue Lokalisation der „Lichtquelle“ berechnet. Nach einer Vielzahl von Schaltzyklen können dann aus den einzelnen Punkten Bilder rekonstruiert werden, deren Auflösung weit unterhalb von 200 nm liegt. Wie gut diese als „Photoactivated Localization Microscopy“ (PALM) bezeichnete Methode funktioniert, hängt stark von der Qualität der verwendeten Fluoreszenzfarbstoffe ab. Genetisch codierte Fluoreszenzfarbstoffe, haben den großen Vorteil, dass sie als DNA-Sequenz in die Zelle eingebracht werden können. Das entsprechende fluoreszierende Protein wird dann von der Zelle selbst produziert. Zusätzlich kann die kodierende DNA Sequenz durch gentechnologische Methoden mit der Sequenz von zellulären Zielproteinen verbunden werden. Die Zelle produziert dann ein Fusionsprotein, das, abhängig von seiner Funktion, in spezifische subzelluläre Strukturen transportiert wird und dort mikroskopisch untersucht werden kann.
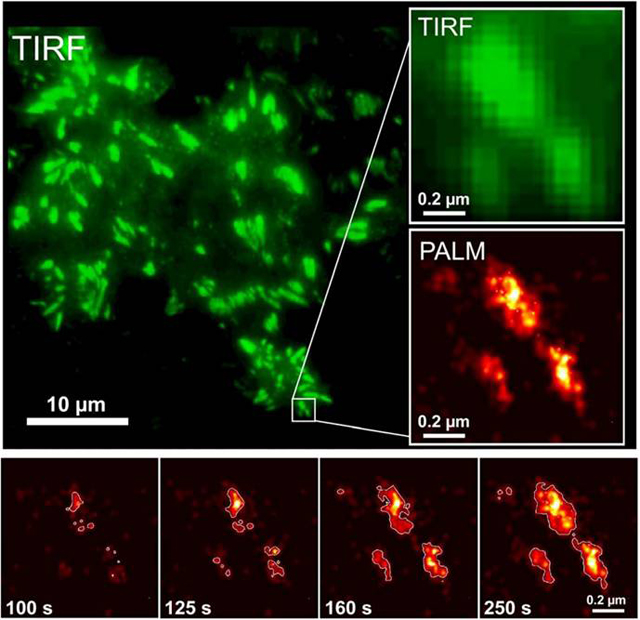
Trotz der Fortschritte in der Auflösung subzellulärer Strukturen stellt die Darstellung von dynamischen Proteinbewegungen innerhalb der lebenden Zelle zusammen mit optischer Höchstauflösung nach wie vor eine besondere Herausforderung dar. In einer Zusammenarbeit der Arbeitsgruppen von Franz Oswald (Universität Ulm), Ulrich Nienhaus (Karlsruher Institut für Technologie früher Institut für Biophysik Ulm) und Jörg Wiedenmann (National Oceanography Centre Southampton, UK früher Institut für Allgemeine Zoologie und Endokrinologie Ulm) wurde ein fluoreszierendes Protein mit bisher einzigartigen Eigenschaften entwickelt, das erstmals eine Analyse solcher dynamischen Vorgänge ermöglicht: Die Fluoreszenzfarbe des als „mIrisFP“ bezeichneten Proteins lässt sich durch Bestrahlung mit Laserlicht von grün auf rot umschalten. Darüber hinaus kann sowohl die grüne als auch die rote Form gezielt ein und ausgeschaltet werden. Durch diese Eigenschaften ist es nun möglich Proteinwanderungen in der lebenden Zelle in optischer Höchstauflösung zu beobachten. Zusätzlich wurde die Eigenschaft des Farbstoffs, Multimere zu bilden, durch die gezielte Veränderung der Aminosäuresequenz minimiert. Auf diese Weise konnten die Einsatzmöglichkeiten als Fusionsmarker deutlich optimiert werden.
Die Forscher konnten mit Hilfe von mIrisFP zum ersten Mal molekulare Umbauvorgänge in den Anheftungspunkten bei der Wanderung von menschlichen Krebszellen beobachten. Das mIrisFP Prinzip eröffnet vielfältige Möglichkeiten, zelluläre Prozesse auf der Ebene von Einzelmolekülen zu analysieren und wurde jetzt in der renomierten Fachzeitschrift „Nature Methods“ vorgestellt.
A photoactivatable marker protein for pulse-chase imaging with superresolution. Jochen Fuchs, Susan Boehme, Franz Oswald, Per Niklas Hedde, Maike Krause, Jörg Wiedenmann & G Ulrich Nienhaus (2010) Nature Methods, 7: 627-630, doi: 10.1038/nmeth.1477
Kontakt
PD Dr. Franz Oswald
Zentrum für Innere Medizin
Universitätsklinik Ulm
Abteilung Innere Medizin I
Albert-Einstein-Allee 23
89081 Ulm
Tel. 0731-500-44544
